Titration und von Titrationen in der Chemie
Titration ist ein grundlegendes Analyseverfahren in der Laborchemie, das es ermöglicht, die Konzentration einer unbekannten Lösung zu bestimmen. Das Basisprinzip besteht darin, dass eine Lösung bekannter Konzentration, auch Standardlösung genannt, langsam zu der zu untersuchenden Lösung hinzugefügt wird. Der Punkt, an dem die Reaktion vollständig abgelaufen ist, wird als Äquivalenzpunkt Ermittlung bezeichnet und kann durch verschiedene Methoden, wie etwa den Indikator Farbumschlag, bestimmt werden.
Es gibt verschiedene Arten von Titrationen, darunter Säure-Base-Titrationen, bei denen der pH-Wert überwacht wird, um den Endpunkt zu erkennen. Andere Typen umfassen Redox-Titrationen, Fällungstitrationen und komplexometrische Titrationen. Jede Methode nutzt spezifische chemische Reagenzien und Analysetechniken, um Konzentrationsbestimmung und andere quantitative Analysen durchzuführen.
Vor Beginn der eigentlichen Titration müssen bestimmte Vorbereitungen getroffen werden. Dazu gehören das Kalibrieren der Ausrüstung, insbesondere der Burette, und die Überprüfung, ob alle verwendeten Lösungen korrekt vorbereitet sind. Eine präzise Burette Verwendung garantiert genaue Messwerte, während eine regelmäßige Kalibrierung hilft, Fehler zu minimieren.
Während der Durchführung einer Titration sollte jede Zugabe des Titrationsmittels sorgfältig dokumentiert werden. Die Datenaufzeichnung erleichtert später die Berechnung der Ergebnisse und die zeichnerische Darstellung der Titrationskurve. Schließlich erfolgt die Analyse der Resultate und deren Interpretation im Kontext der bestehenden Theorien zum chemischen Gleichgewicht und anderen relevanten Konzepten in der Lösung Chemie.
Sicherheitsmaßnahmen spielen ebenfalls eine wichtige Rolle. Sorgfältiger Umgang mit Chemikalien und korrekte Anwendungstechnik verhindern Unfälle und stellen sicher, dass die Messergebnisse zuverlässig und reproduzierbar sind.
Das Wichtigste in Kürze
- Titration bestimmt die Konzentration einer Lösung mittels Zugabe eines Reagenz bekannter Konzentration.
- Der Äquivalenzpunkt ist der vollständige Reaktionspunkt, oft durch Farbumschlag eines Indikators erkennbar.
- Es gibt verschiedene Titrationsarten: Säure-Base, Redox, Fällung, und komplexometrische Titrationen.
- Exakte Kalibrierung und saubere Ausrüstung sind entscheidend für präzise Titrationsergebnisse.
- Während der Titration wird das Volumen des verbrauchten Reagens genau dokumentiert.
Definition und Basisprinzip der Titration
Die Titration ist ein Analyseverfahren, das in der Chemie weit verbreitet ist, um die Konzentration einer unbekannten Lösung zu bestimmen. Dabei wird ein Reagenz mit bekanntem Gehalt, auch als Titrationsmittel bezeichnet, schrittweise zu einer Probelösung hinzugefügt. Während dieser Zugabe beobachtet man eine chemische Reaktion, typischerweise eine Säure Base Reaktion, bis ein definierter Punkt erreicht ist.
Der Prozess basiert auf dem Prinzip des chemischen Gleichgewichts, wobei sich die Ausgangsstoffe in der Lösung quantitativ umsetzen können. Ein wichtiger Aspekt bei der Titration ist die Neutralisationsreaktion zwischen Säuren und Basen, bei der der pH-Wert der Lösung überwacht wird. Eine gängige Methode zur Überwachung der Reaktion ist die Verwendung eines Indikators, der durch einen Farbumschlag anzeigt, wann der sogenannte Äquivalenzpunkt erreicht ist. Der Äquivalenzpunkt ist jener Moment, in dem die Mengen an Reagenzien exakt im stöchiometrischen Verhältnis vorliegen.
Zu den häufig angewendeten Arten von Titrationen gehören die volumetrische Analyse und die Konzentrationsbestimmung. Als Werkzeug kommt dabei oft eine Burette zum Einsatz, die eine präzise Dosierung der Reagenzzugabe ermöglicht.
Am Ende der Titration erfolgt eine Berechnung der Ergebnisse basierend auf dem verbrauchten Volumen des Titrationsmittels. Dies erfordert genaue Datenaufzeichnung und sorgfältige Durchführung, um fehlerfreie Resultate zu gewährleisten. Die Titration ist somit ein unverzichtbares Instrument in der modernen Laborchemie und spielt eine Schlüsselrolle bei der Quantifizierung chemischer Substanzen.
Chemie ist die Fähigkeit, in der Küche Explosionen zu verhindern. – Marcel Proust
| Begriff | Erklärung |
|---|---|
| Titration | Analyseverfahren zur Bestimmung der Konzentration einer unbekannten Lösung. |
| Standardlösung | Lösung mit bekannter Konzentration, die in der Titration verwendet wird. |
| Äquivalenzpunkt | Punkt, an dem die Reaktion vollständig abgelaufen ist. |
| Indikator | Stoff, der durch Farbumschlag den Endpunkt der Titration anzeigt. |
| Burette | Gerät zur präzisen Dosierung der Titrationsmittel. |
| Titrationskurve | Graphische Darstellung der Titrationsergebnisse. |
| chemisches Gleichgewicht | Zustand, bei dem die Reaktion in beide Richtungen gleich schnell abläuft. |
| Lösung Chemie | Studie der chemischen Eigenschaften und Reaktionen innerhalb einer Lösung. |
Verschiedene Arten von Titrationen
Es gibt verschiedene Arten von Titrationen, jede mit ihrem spezifischen Anwendungsgebiet und Prinzip. Die bekannteste Form ist die Säure-Base-Titration, bei der eine Säure mit einer Base oder umgekehrt titriert wird. Hierbei spielt der pH-Wert eine zentrale Rolle, und ein Indikator zeigt den Farbumschlag an, sobald der Neutralisationspunkt erreicht ist.
Eine weitere bedeutende Methode ist die Redox-Titration. Hier werden Reduktions- und Oxidationsreaktionen genutzt, um die Konzentration eines Stoffes zu bestimmen. Beispielsweise kann Kaliumpermanganat als Titrationsmittel verwendet werden, das durch seine intensive Farbe auch ohne zusätzlichen Indikator sichtbar macht, wann der Endpunkt erreicht ist.
Komplexometrische Titration ist ein weiteres wichtiges Verfahren, besonders in der Analyse und Bestimmung von Metallionen. EDTA (Ethylenediamintetraessigsäure) ist ein häufig verwendetes Reagenz, das stabile Komplexe mit vielen Metallionen bildet und auf diese Weise deren Konzentration bestimmt.
Des Weiteren gibt es Fällungstitration, wobei die Bildung eines unlöslichen Produktes zur Konzentrationsbestimmung führt. Ein klassisches Beispiel ist die Mohrsche Methode zur Chloridbestimmung mittels Silbernitrat.
Für alle diese Typen ist die präzise Kalibrierung der Ausrüstung und die genaue Zugabe des Reagenz aus der Burette entscheidend. Jede dieser Titrationen bietet unterschiedliche Möglichkeiten, sie müssen jedoch stets korrekt durchgeführt werden, um zuverlässige Ergebnisse zu erzielen.
Arten auf einem Blick
- Säure-Base-Titrationen: Hier wird die Konzentration einer Säure oder Base bestimmt.
- Redox-Titrationen: Diese werden verwendet, um die Konzentration von Oxidations- oder Reduktionsmitteln zu bestimmen.
- Komplexometrische Titrationen: Diese werden eingesetzt, um Metallionen zu bestimmen, die mit Komplexbomliganden reagieren.
- Fällungstitrationen: Hier wird die Konzentration eines unlöslichen Salzes bestimmt, indem ein Fällungsreaktion durchgeführt wird.
- Argentometrische Titrationen: Diese werden verwendet, um Chloridionen durch Zugabe von Silbernitrat zu bestimmen.
- Konduktometrische Titration: Bei der konduktometrischen Titration wird die elektrische Leitfähigkeit einer Lösung gemessen, um den Äquivalenzpunkt der Reaktion zu bestimmen. Diese Methode wird häufig bei der Bestimmung von Ionenkonzentrationen eingesetzt.
- Potentiometrische Titration: Die potentiometrische Titration basiert auf der Messung der Spannung oder des elektrischen Potentials einer Lösung während der Titration. Durch die Verfolgung der Änderung des Potentials in Abhängigkeit von der zugegebenen Titrationslösung kann der Äquivalenzpunkt genau bestimmt werden.
Chemische Reagenzien und ihre Eigenschaften
Die Auswahl der geeigneten chemischen Reagenzien ist entscheidend für eine erfolgreiche Titration. Reagenzien sind die Substanzen, die in der Titration verwendet werden, um mit der zu analysierenden Probe zu reagieren. Es gibt verschiedene Typen von Reagenzien, je nach Art der Titration, zum Beispiel Säuren und Basen für eine Säure-Base-Reaktion.
Ein wichtiges Kriterium bei der Wahl eines Reagenz ist dessen Reinheit. Nur hochreine Substanzen gewährleisten genaue und reproduzierbare Ergebnisse. Zudem sollte das Reagenz stabil sein, um Veränderungen während der Lagerung oder Messung zu vermeiden.
Ein Hauptaspekt ist die Konzentration des Reagenz, welche bekannt und oft genau kalibriert sein muss. Dies gewährleistet präzise Berechnungen bei der Konzentrationsbestimmung der Probe. In der Regel wird eine Standardlösung mit bekannter Konzentration verwendet. Dieses sogenannte Titrationsmittel reagiert mit der Probe in einer quantifizierbaren Weise.
Ein weiteres Merkmal vieler Reagenzien ist ihre Fähigkeit, einen deutlichen Indikator Farbumschlag zu verursachen. Bei einer pH-Wert-Messung beispielsweise zeigt der Farbumschlag an, wann der Äquivalenzpunkt erreicht ist – der Moment, an dem die Mengenverhältnisse von Säure und Base genau stimmen. Diese Eigenschaft unterstützt die Endpunkt-Bestimmung und erhöht die Genauigkeit der Titration erheblich.
Um zuverlässige Ergebnisse zu erzielen, ist es wichtig, dass das verwendete Reagenz frei von Verunreinigungen ist und unter stabilen Bedingungen aufbewahrt wird. Hochwertige Reagenzien erhöhen dabei nicht nur die Präzision, sondern auch die Effizienz der gesamten Analyseverfahren in der Laborchemie.
Vorbereitung und Kalibrierung der Ausrüstung
Die richtige Vorbereitung und Kalibrierung der Ausrüstung ist entscheidend, um präzise und verlässliche Ergebnisse bei einer Titration zu erzielen. Zunächst einmal sollten Sie sicherstellen, dass alle benötigten Geräte sauber und trocken sind. Die wichtigsten Instrumente für diesen Schritt sind die Burette, der Messkolben und das Pipettenwerkzeug.
Beginnen Sie mit dem Kalibrieren der Ausrüstung. Dies geschieht durch die Verwendung einer Standardlösung bekannter Konzentration. Füllen Sie die Burette mit dieser Standardlösung und notieren Sie den initialen Stand. Anschließend geben Sie die Lösung schrittweise in den Messkolben oder einen anderen geeigneten Behälter ab. Notieren Sie den Stand der Burette nach jedem Schritt genau, um mögliche Abweichungen festzustellen und zu korrigieren.
Es ist ebenso wichtig, dass Ihre Lösung korrekt angesetzt und homogen gemischt ist. Verwenden Sie dabei destilliertes Wasser und Chemiereagenzien von hoher Reinheit. Achten Sie darauf, Luftblasen aus der Burette zu entfernen, bevor Sie mit der eigentlichen Titration beginnen. Dies kann durch leichtes Klopfen an die Wand der Burette erreicht werden.
Eine sorgfältige Überprüfung aller Verbindungen und Dichtungen auf Dichtigkeit ist unerlässlich, da schon kleine Leckagen die Messergebnisse verfälschen können. Sobald alles vorbereitet und überprüft ist, können Sie mit der eigentlichen Reagenz Zugabe fortfahren, wobei die Anwendung einfacher Laborchemie-Grundsätze zur präzisen Dosierung beiträgt.
Durch diese gründliche Vorbereitung und Kalibrierung gewährleisten Sie eine zuverlässige und genaue Durchführung Ihrer Titrationen.
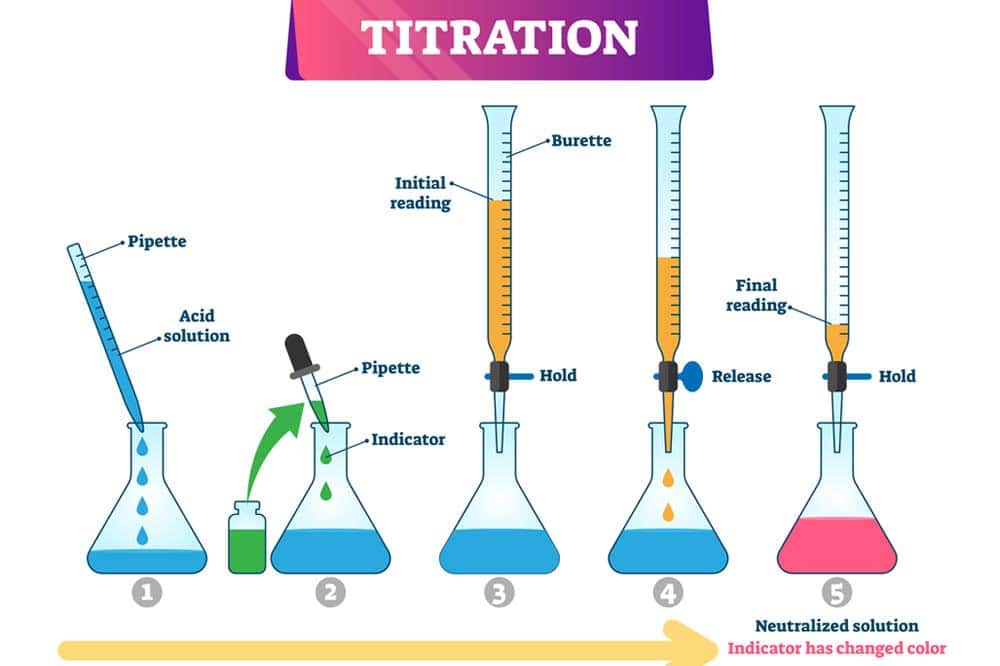
Durchführung einer Titration Schritt-für-Schritt
Um eine Titration durchzuführen, sind einige wichtige Schritte zu beachten. Zunächst sollte man alle benötigten Materialien und Reagenzien vorbereiten. Dazu gehören eine Burette, die zu füllende Lösung (Titrand) sowie das Titrationsmittel (Reagenz). Es ist essenziell, die Burette korrekt zu kalibrieren, um genaue Messungen zu gewährleisten.
Füllen Sie die Burette mit dem Titrationsmittel und achten Sie darauf, dass keine Luftblasen vorhanden sind. Stellen Sie sicher, dass die Konzentration der Standardlösung bekannt ist. Sobald alles bereit ist, wird die Probe in einen Erlenmeyerkolben gegeben. Dem Titrand fügt man nun einige Tropfen eines geeigneten Indikators hinzu, wodurch ein sichtbarer Farbumschlag ermöglicht wird.
Die eigentliche Titration beginnt damit, dass Sie langsam das Titrationsmittel aus der Burette in die Probelösung geben und gleichzeitig den pH-Wert oder die Farbveränderung kontinuierlich beobachten. Schwenken Sie den Kolben vorsichtig, um eine gleichmäßige Mischung der Lösungen sicherzustellen. Die Zugabe des Titrationsmittels erfolgt bis kurz vor den Punkt, an dem der Indikator seinen endgültigen Farbumschlag zeigt – dies nennt man den Endpunkt.
Am Äquivalenzpunkt haben die Mengen an Säure und Base ein chemisches Gleichgewicht erreicht, was über eine Titrationskurve visualisiert werden kann. Notieren Sie sich das verbrauchte Volumen des Titrationsmittels genau. Durch Berechnungen können Sie anschließend die Konzentration der unbekannten Lösung bestimmen.
Die Durchführung einer Titration erfordert sorgfältiges Arbeiten und eine präzise Beobachtung. Zudem sollten auch Sicherheitsmaßnahmen beachtet werden, um Fehler zu vermeiden und aussagekräftige Ergebnisse zu erzielen.
| Begriff | Eigenschaften | Verwendung |
|---|---|---|
| Titrationsmittel | Hohe Reinheit, stabile Konzentration | Konzentrationsbestimmung einer Probe |
| Äquivalenzpunkt | Stöchiometrisches Verhältnis, vollständige Reaktion | Ermittlung der exakten Menge |
| Burette | Präzise Skala, keine Luftblasen | Kontrollierte Zugabe des Reagenz |
Datenaufzeichnung und Berechnung der Ergebnisse
Eine präzise Datenaufzeichnung ist entscheidend, um zuverlässige Ergebnisse bei einer Titration zu erhalten. Während des Verfahrens sollte das Volumen des Titrationsmittels in der Burette genau notiert werden, insbesondere zu dem Zeitpunkt, an dem der Indikator Farbumschlag beobachtet wird.
Nachdem alle Daten erfasst wurden, beginnt die Berechnung der Ergebnisse. Zuerst wird das Gesamtvolumen des verbrauchten Titrationsmittels bestimmt. Dabei muss darauf geachtet werden, dass eventuelle Messfehler durch sorgfältiges Ablesen und Notieren vermieden werden. Die Konzentrationsbestimmung erfolgt dann mithilfe der Formel:
C1V1 = C2V2
Diese Gleichung stellt sicher, dass neue Lösungen unter Berücksichtigung der Konzentrationen beider Reagenzien berechnet werden können. Der Äquivalenzpunkt gibt an, wann gleiche Molenmengen an Säure und Base reagieren und ist oft einfacher mittels einer grafischen Darstellung auf der Titrationskurve zu erkennen.
Durch den Vergleich dieser Punkte mit bekannten Standardwerten kann die genaue Konzentration der Unbekannten Lösung bestimmt werden. Es ist wichtig, regelmäßig Kontrolltitrationen durchzuführen, um wiederholbare und verlässliche Daten zu gewährleisten. Dieser Prozess unterstützt dabei, mögliche Fehlerquellen im Analyseverfahren zu identifizieren und sie entsprechend zu korrigieren.
Analyse und Interpretation der Resultate
Die Analyse und Interpretation der Resultate einer Titration ist von zentraler Bedeutung, um genaue Konzentrationsbestimmungen durchzuführen. Nach der Durchführung der Titration müssen die erhaltenen Daten sorgfältig ausgewertet werden.
Zunächst wird die aufgenommenen Volumen der Titrationslösung mit den bekannten Konzentrationen verglichen. Die Darstellung der Daten in Form einer Titrationskurve bietet eine visuelle Unterstützung bei der Interpretation. Hierbei zeigt der sprunghafte Anstieg oder Abfall des pH-Werts den Punkt der Säure-Base-Reaktion an, der Äquivalenzpunkt.
Der Äquivalenzpunkt markiert den Punkt, an dem genau genug Reagens hinzugefügt wurde, um die vorhandenen Stoffe in der Lösung vollständig zu neutralisieren. Dies geschieht oft in Begleitung eines Indikator Farbumschlags, was die Endpunkt-Erkennung erleichtert. Das genaue Bestimmen dieses Punktes ermöglicht es, die ursprüngliche Konzentration der Probe über stöchiometrische Berechnungen zu ermitteln.
In der Laborchemie sind präzise Messungen entscheidend. Daher sollten auch kleinere Abweichungen notiert und analysiert werden, um systematische Fehler auszuschließen. Die Nutzung gut kalibrierter Instrumente wie der Burette stellt sicher, dass die Messungen zuverlässig sind.
Zusammenfassend lässt sich sagen, dass die quantitative Analyse ein wertvolles Werkzeig im Prozess der Neutralisationsreaktion darstellt, da akribische Datenerfassung und -auswertung unabdingbar für korrekte Ergebnisse sind.
Sicherheitsmaßnahmen und Fehlervermeidung
Beim Arbeiten mit Chemikalien und komplexen Analyseverfahren wie einer Titration ist es unabdingbar, bestimmte Sicherheitsmaßnahmen zu beachten, um Unfälle zu vermeiden.
Zunächst sollten immer geeignete Schutzkleidung wie Laborkittel, Handschuhe und Schutzbrille getragen werden, da viele Chemikalien ätzend oder giftig sein können. Die Verwendung eines Abzuges ist empfohlen, besonders wenn flüchtige oder toxische Dämpfe entstehen könnten.
Eine sorgfältige Vorbereitung und Kalibrierung der Ausrüstung, speziell der Burette, sind entscheidend. Kleine Fehler bei der Volumenmessung können große Auswirkungen auf das Endergebnis haben. Es ist wichtig, die Burette vor jeder Verwendung gründlich zu spülen und sicherzustellen, dass keine Luftblasen im System vorhanden sind.
Während der Durchführung der Titration muss sorgfältig gearbeitet werden, um Messfehler zu minimieren. Die Zugabe des Reagenzes sollte langsam und kontrolliert erfolgen, insbesondere in der Nähe des Äquivalenzpunktes. Ein präziser Indikator Farbumschlag oder die genaue pH Wert Messung sind essenziell für eine korrekte Endpunkt Bestimmung.
Es ist auch ratsam, alle Schritte und Beobachtungen genau zu dokumentieren, einschliesslich der Temperatur, da diese die Ergebnisse beeinflussen kann. Regelmäßiges Überprüfen und Kalibrieren der verwendeten Geräte hilft ebenfalls, Fehlerquellen einzudämmen.
Durch das Befolgen dieser Vorsichtsmaßnahmen und das gewissenhafte Arbeiten lassen sich valide und zuverlässige Ergebnisse erzielen, was bei der Quantitative Analyse von größter Bedeutung ist.