Leitet Salz Strom? Die elektrische Leitfähigkeit von Salzlösungen?
Warum leiten Salzlösungen den elektrischen Strom? Die Antwort auf diese Frage liegt in der chemischen Zusammensetzung und dem Verhalten von Salzen im Wasser. Wenn sich ein Salz, wie zum Beispiel Kochsalz (Natriumchlorid), in Wasser löst, zerfällt es in seine ionischen Bestandteile, nämlich Kationen und Anionen.
Diese Ionen bewegen sich frei in der Lösung und ermöglichen dadurch den Fluss elektrischer Ladung. Damit eine Substanz den elektrischen Strom effektiv leiten kann, benötigt sie bewegliche Ladungsträger. In einer Salzlösung übernehmen die positiven und negativen Ionen diese Rolle, was zur elektrischen Leitfähigkeit von Salzlösungen führt. Je höher die Konzentration der Ionen in der Lösung ist, desto besser ist ihre Fähigkeit, Strom zu leiten.
Das Wichtigste in Kürze
- Salzlösungen leiten elektrischen Strom durch frei bewegliche Ionen.
- Dissoziation von Salzen im Wasser erzeugt Kationen und Anionen.
- Je höher die Ionenkonzentration, desto besser die Leitfähigkeit.
- Bewegung der Ionen ermöglicht Ladungsfluss bei angelegter Spannung.
- Elektrodenanalyse zeigt chemische Reaktionen und Stromfluss.
Salzlösungen leiten elektrischen Strom, weil sie gelöste Ionen enthalten, die als Ladungsträger fungieren. Diese gelösten Ionen ermöglichen den Fluss von Elektronen und tragen so zur Leitfähigkeit bei. Durch die Anwesenheit dieser geladenen Teilchen können Salzlösungen elektrischen Strom leiten, da sie die elektrische Ladung transportieren können. Die Ionen in der Salzlösung ermöglichen somit den Durchfluss von elektrischem Strom.
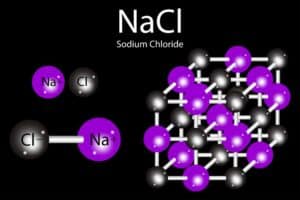
Salz zerfällt in Ionen im Wasser
Wenn Salz, wie zum Beispiel Kochsalz (NaCl), in Wasser gelöst wird, zerfällt es in seine Bestandteile. Diese Bestandteile sind Ionen – nämlich Natriumionen (Na+) und Chloridionen (Cl–). Dieser Prozess ist als Dissoziation bekannt und geschieht aufgrund der chemischen Eigenschaften von Salz.
Durch das Lösen im Wasser sorgen die elektrisch geladenen Ionen für die Leitfähigkeit. Wasser umgibt jedes Ion mit einem Cluster aus Wassermolekülen und sorgt dafür, dass sie sich frei bewegen können. Dies erzeugt eine Lösung, in der sich die geladenen Teilchen ungehindert bewegen können.
Dank dieser Bewegungsfreiheit der Ionen kann ein elektrischer Strom durch die Salzlösung fließen. Das Prinzip dabei ist simpel: Positive Ionen wandern zur negativen Elektrode, während negative Ionen zur positiven Elektrode wandern. Diese Bewegung der Ionen erlaubt den Ladungstransport und ermöglicht somit die Leitfähigkeit von Salzwasser.
Die elektrische Leitfähigkeit von Salzlösungen hängt davon ab, wie viele Ionen in der Lösung vorhanden sind. Je höher die Konzentration der Ionen, desto besser ist die Leitfähigkeit. In wissenschaftlichen Experimenten lässt sich diese Leitfähigkeit genau messen, wobei ein Leitfähigkeitsmessgerät für Salzwasser eingesetzt wird. Die Messergebnisse zeigen deutlich, dass schon geringe Veränderungen im Salzgehalt zu einer spürbaren Veränderung der Leitfähigkeit führen.
Dieser Prozess ist nicht nur in der Chemie interessant, sondern hat auch praktische Anwendungen in verschiedenen Bereichen. Beispielsweise werden solche Messungen verwendet, um die Wasserqualität zu überprüfen oder industrielle Prozesse zu überwachen.
Chemie ist die Welt der Wunder im Kleinsten: Atome und Moleküle tanzen in geordneter Unordnung und zeigen ihre Magie. – Marie Curie
| Aspekt | Beschreibung |
|---|---|
| Leitfähigkeit von Salze | Fähigkeit von Salzen, in gelöster Form Strom zu leiten. |
| Leitfähigkeit von Salzwasser | Elektrische Leitfähigkeit von Meerwasser oder anderen Lösungen mit gelöstem Salz. |
| Leitfähigkeit von Kochsalz | Elektrische Leitfähigkeit von Natriumchlorid (NaCl) in Lösung. |
| Einfluss von Salz auf elektrische Leitfähigkeit | Wie verschiedene Salzkonzentrationen die Fähigkeit beinflussen, Elektrizität zu leiten. |
| Elektrolyse von Salzlösungen | Zersetzung von Salzlösungen durch einen elektrischen Strom. |
| Messung der Leitfähigkeit von Salzlösungen | Verwendung von Leitfähigkeitsmessgeräten zur Bestimmung der elektrischen Leitfähigkeit von Lösungen. |
Ionen bewegen sich frei in Lösung
Im Wasser gelöstes Salz zerfällt in Ionen, das heißt in positiv und negativ geladene Teilchen. Dies geschieht, weil die Wassermoleküle stark genug sind, um die ionischen Bindungen im Salzkristall zu brechen.
Einmal aufgespalten, bewegen sich diese Ionen frei in der Lösung. Diese Beweglichkeit ist entscheidend für die elektrische Leitfähigkeit von Salzlösungen. Wenn eine elektrische Spannung an eine solche Lösung angelegt wird, wandern die positiven Ionen zur negativen Elektrode und die negativen Ionen zur positiven Elektrode.
Durch diese Bewegung der Ionen kann elektrischer Strom durch die Lösung fließen. Die Mobilität der Ionen ermöglicht also den Ladungsfluss und damit die Leitfähigkeit. Es ist wichtig zu verstehen, dass unterschiedliche Salze verschiedene Eigenschaften haben können, die ihre Leitfähigkeit beeinflussen.
Die Leitfähigkeit von Salzwasser hängt daher nicht nur von der Art des verwendeten Salzes, sondern auch von seiner Konzentration ab. Je höher die Salzkonzentration, desto mehr Ionen stehen zur Verfügung, wodurch die Leitfähigkeit zunimmt. So spielt der Salzgehalt eine entscheidende Rolle bei der Bestimmung der allgemeinen Leitfähigkeit der Lösung.
Wenn man diese Prinzipien berücksichtigt, sehen wir, wie sich chemische Eigenschaften direkt auf physikalische Phänomene auswirken und wie die Wechselwirkungen zwischen Salz und Wasser die Leitfähigkeit beeinflussen.
Positive und negative Ionen leiten Strom
Salzlösungen leiten den elektrischen Strom, weil sie geladene Teilchen enthalten. Diese geladenen Teilchen nennt man Ionen, dabei handelt es sich um positiv geladene Kationen und negativ geladene Anionen.
Positive Ionen werden als Cationen bezeichnet. Sie entstehen, wenn ein Atom oder Molekül Elektronen verliert. Beispiele hierfür sind Natrium- (Na+) oder Kalium- (K+) Ionen.
Negative Ionen, die sogenannten Anionen, entstehen durch das Aufnehmen von Elektronen. Chlorid-Ionen (Cl–) sind typische Vertreter dieser Kategorie.
Wenn Salz im Wasser gelöst wird, trennen sich die Salzkristalle in ihre Bestandteile auf. Dieses Phänomen nennt man Dissoziation. Die entstandenen Ionen verteilen sich frei in der Lösung und können sich bewegen. Sobald eine elektrische Spannung angelegt wird, beginnen die Ionen zu wandern:
- Kationen (positive Ionen) bewegen sich zur negativ geladenen Elektrode (Kathode).
- Anionen (negative Ionen) bewegen sich zur positiv geladenen Elektrode (Anode).
Diese Bewegung der Ionen ermöglicht den Fluss von elektrischem Strom durch die Lösung. Dies unterscheidet sich grundlegend vom Verhalten fester Salze, wie z.B. Kochsalz. Im festen Zustand stehen keine freien Ladungsträger zur Verfügung, weshalb feste Salzkristalle den Strom nicht leiten können.
In wässrigen Lösungen ist jedoch die Konzentration der Ionen entscheidend für die Leitfähigkeit. Eine höhere Konzentration an Ionen bedeutet eine höhere Leitfähigkeit von Salzwasser. Mit anderen Worten: Je mehr Salz im Wasser gelöst ist, desto besser kann der elektrische Strom fließen.
Elektrischer Strom erfordert bewegliche Ladungsträger
Um zu verstehen, warum Salzlösungen den elektrischen Strom leiten, ist es hilfreich, zunächst einige Grundlagen der Elektrizität zu betrachten. Elektrischer Strom entsteht durch die Bewegung von geladenen Teilchen, den sogenannten Ladungsträgern. Diese können entweder Elektronen oder Ionen sein. Während in Metallen hauptsächlich Elektronen als Ladungsträger agieren, sind es in wässrigen Lösungen meist Ionen.
Wird ein Salz wie Natriumchlorid (NaCl) im Wasser gelöst, zerfällt es in seine Bestandteile: die positiv geladenen Natriumionen (Na+) und die negativ geladenen Chloridionen (Cl–). Diese Ionen bewegen sich frei in der Lösung umher. Wenn eine elektrische Spannung angelegt wird, wandern die Natriumionen zur negativen Elektrode und die Chloridionen zur positiven Elektrode. Dadurch fließt elektrischer Strom.
Damit dieser Prozess effizient ablaufen kann, müssen ausreichend viele Ionen in der Lösung vorhanden sein. Deshalb hängt die Leitfähigkeit von Salzwasser direkt vom Salzgehalt ab. Je höher die Konzentration der gelösten Ionen, desto besser kann die Lösung elektrischen Strom leiten. Dies macht sich besonders bemerkbar bei der Messung der Leitfähigkeit von Salzlösungen, wo höhere Ionenkonzentrationen bessere Leitfähigkeitswerte ergeben.
Insgesamt zeigt sich, dass für die elektrische Leitfähigkeit von Salzlösungen die Rolle beweglicher Ladungsträger essenziell ist. Die Ionenkonzentration und ihre Beweglichkeit in der Lösung bestimmen maßgeblich die Fähigkeit einer Salzlösung, Strom zu leiten.
Ionen ermöglichen Ladungsfluss in Salzlösung
In einer Salzlösung ermöglichen Ionen den Ladungsfluss. Wenn ein Salz wie Natriumchlorid (Kochsalz) im Wasser gelöst wird, zerfällt es in seine Bestandteile: die positiv geladenen Natriumionen (Na+) und die negativ geladenen Chloridionen (Cl–). Diese Ionen sind frei beweglich und spielen eine entscheidende Rolle bei der elektrischen Leitfähigkeit der Lösung.
Elektrischer Strom erfordert das Vorhandensein von beweglichen Ladungsträgern. In einer Salzlösung übernehmen die Ionen diese Funktion. Sobald eine Spannung angelegt wird, beginnen sich die Na+-Ionen zur negativen Elektrode zu bewegen, während die Cl–-Ionen zur positiven Elektrode wandern. Diese Bewegung der Ionen führt zu einem Ladungsfluss, der als elektrischer Strom gemessen werden kann.
Die Fähigkeit einer Salzlösung, elektrischen Strom zu leiten, ist eng mit der Konzentration der Ionen verbunden. Eine höhere Ionenkonzentration führt zu einer besseren Leitfähigkeit, da mehr mobile Ladungsträger vorhanden sind. Dies erklärt auch, warum Meerwasser – mit seinem hohen Salzgehalt – eine ausgezeichnete elektrische Leitfähigkeit besitzt.
Salzkonzentration und elektrische Leitung sind daher direkt miteinander verknüpft. Je höher der Anteil an gelösten Salzen, desto besser die Leitfähigkeit der Lösung.
Ein weiterer interessanter Aspekt ist die Elektrolyse von Salzlösungen. Hierbei werden chemische Verbindungen durch Anlegen eines elektrischen Stroms aufgespalten, was wiederum zeigt, welche bedeutende Rolle Ionen bei der elektrischen Leitfähigkeit von Salzlösungen spielen.
| Eigenschaft | Beispiel | Bedeutung |
|---|---|---|
| Leitfähigkeit von Salzwasser | Meerwasser | Hoher Salzgehalt ermöglicht hervorragende Leitfähigkeit |
| Leitfähigkeit von Kochsalzlösungen | NaCl-Lösung | Weit verbreitetes Beispiel für ionische Leitfähigkeit |
| Salzgehalt und Leitfähigkeit | Brackwasser | Beispiel für die Variabilität der Leitfähigkeit in natürlichen Gewässern |
Höhere Ionenkonzentration, bessere Leitfähigkeit
Wenn es um die Leitfähigkeit von Salzlösungen geht, spielt die Ionenkonzentration eine entscheidende Rolle. Je mehr Ionen sich in der Lösung befinden, desto besser kann sie elektrischen Strom leiten. Dies liegt daran, dass mehr Ionen zur Verfügung stehen, um den elektrischen Strom zu transportieren.
Eine höhere Salzkonzentration führt also zu einer besseren Leitfähigkeit. Zum Beispiel zeigt Salzwasser mit einer hohen Konzentration von Kochsalz eine signifikant bessere elektrische Leitfähigkeit als Wasser mit nur wenig Salz. Die Beweglichkeit der Ionen nimmt nicht unbedingt linear mit der Konzentration zu, aber die Anzahl der Ionen trägt maßgeblich zur Leitfähigkeit bei.
Die Messung der Leitfähigkeit von Salzlösungen wird häufig im Labor durchgeführt, um die Salzgehalte verschiedener Lösungen zu vergleichen. Ein gängiges Instrument hierfür ist das Leitfähigkeitsmessgerät für Salzwasser. Es ermöglicht genaue Messungen, die wichtige Aufschlüsse über die Zusammensetzung und Qualität der Lösung geben können.
Durch diese präzisen Messungen lässt sich nachvollziehen, wie der „Salzgehalt und Leitfähigkeit“ zusammenhängen. Der Einfluss von Salz auf die elektrische Leitfähigkeit kann daher auf vielfältige Weise dokumentiert und analysiert werden. Anwendungen finden sich sowohl in der Chemie als auch in der Physik, wo die xelektrische Eigenschaften von Salz intensiv untersucht werden.
Elektrolyte zersetzen sich an Elektroden
Elektrolyte zersetzen sich an Elektroden
Wenn eine elektrische Spannung angelegt wird, bewegen sich die Ionen in der Lösung auf die Elektroden zu. Dies führt zu elektrochemischen Reaktionen an den Elektroden. Ein sehr bekannter Prozess ist die Elektrolyse von Salzlösungen, bei der zum Beispiel Wasser oder Kochsalzlösung (NaCl) verwendet werden kann.
An der Kathode (der negativen Elektrode) treten positive Ionen (Kationen) zur Reduktion ein. Dabei nehmen sie Elektronen auf und wandeln sich in neutrale Atome oder Moleküle um. Zum Beispiel: Na+ + e– → Na.
An der Anode (der positiven Elektrode) hingegen geben negative Ionen (Anionen) ihre überschüssigen Elektronen ab und oxidieren. Ein klassisches Beispiel ist die Oxidation von Chlor-Ionen: 2 Cl– → Cl2 + 2 e–.
Die Veränderung der Leitfähigkeit mit Salzkonzentration ist direkt koppelbar an diesen Vorgang. Je mehr Ionen in der Lösung vorhanden sind, desto besser leitet die Lösung den elektrischen Strom. Dies liegt an der erhöhten Bewegung der freien Ladungsträger in der Lösung.
Daher ist die Leitfähigkeit von Salzwasser stark abhängig vom Salzgehalt und der Art des darin gelösten Salzes. Um diese Eigenschaften zu quantifizieren, kommt oft ein Leitfähigkeitsmessgerät für Salzwasser zum Einsatz. Dieses Instrument misst die ionische Leitfähigkeit und gibt Hinweise auf die Salzkonzentration und deren Fähigkeit zur elektrischen Leitung.
Leitet Salzwasser Strom?
Ja, Salzwasser leitet Strom aufgrund der gelösten Salze, die in Form von Ionen vorliegen und den elektrischen Stromfluss ermöglichen. Es leitet den Strom durch die Anwesenheit von gelösten Salzen, die in Form von Ionen vorliegen. Diese geladenen Teilchen ermöglichen den Transport von elektrischer Ladung, was den elektrischen Stromfluss im Salzwasser ermöglicht.
Warum leitet Salzwasser Strom?
Salzwasser leitet Strom, weil es gelöste Salze enthält, die in Form von Ionen vorliegen. Diese geladenen Partikel ermöglichen den Transport von Ladungsträgern und somit den elektrischen Stromfluss. Die Anwesenheit von gelösten Ionen in Salzwasser ermöglicht es, dass elektrischer Strom durch das Wasser geleitet werden kann.