Was ist Konformationelle Isomerie?
Die konformationelle Isomerie ist ein faszinierendes Phänomen in der organischen Chemie, das durch verschiedene räumliche Ausrichtungen von Atomgruppen innerhalb eines Moleküls definiert wird. Diese Art der Isomerie entsteht hauptsächlich durch die freie Drehung um Einfachbindungen und ist ein wesentlicher Aspekt bei der Betrachtung der chemischen und physikalischen Eigenschaften von Verbindungen.
Ein herausragendes Beispiel für konformationelle Isomere ist die Rotationsisomerie, auch als interne Rotation bekannt. Hierbei unterscheidet man oft zwischen Gauche- und Anti-Isomeren, abhängig davon, wie Atomgruppen relativ zueinander angeordnet sind. Die Analyse solcher Konformationsisomere erfolgt häufig mittels Newman Projektion, einer Darstellungsweise, die die verschiedenen Perspektiven auf die Molekülgeometrie verdeutlicht.
Komplexere Systeme zeigen interessantere Formen der Konformation, wie etwa die Sessel-und Wannenformen bei Cyclohexanringen. Auch Begriffe wie Staggered und Eclipsed Konformationen spielen eine wichtige Rolle bei aliphatischen Kohlenwasserstoffen, da sie sich sowohl energetisch als auch strukturell unterscheiden. Die Flexibilität in Molekülen und ihre Konformerer Energie können zudem erhebliche Auswirkungen auf chemische Reaktionen haben, vor allem aufgrund der sterischen Hinderung, die den Zugang zu bestimmten Reaktionsstellen beeinflusst.
Es gibt etliche Methoden zur Bestimmung dieser Konformationsisomere, einschließlich Molaren Konformationsanalyse und spektraler Techniken. Interessanterweise finden sich Beispiele konformationeller Isomerie nicht nur in synthetischen Molekülen, sondern auch in biologischen Systemen wie Proteinen und Enzymen, wobei deren Struktur maßgeblich die Funktion bestimmt. Besonders in der pharmazeutischen Chemie wird dieses Wissen genutzt, um Wirkstoffe zielgerichtet zu designen und zu optimieren.
Das Wichtigste in Kürze
- Konformationelle Isomerie resultiert aus der freien Drehung um Einfachbindungen in Molekülen.
- Newman-Projektion visualisiert die räumliche Anordnung von Atomen entlang einer C-C-Bindung.
- Wesentliche Konfigurationen: Gauche, Anti-Isomere sowie Staggered und Eclipsed Konformationen.
- Sessel- und Wannenformen von Cyclohexan sind energetisch bedeutende Konformationen.
- Konformationen beeinflussen Reaktivität und Eigenschaften in chemischen und biologischen Systemen.
Konformationelle Isomerie bezieht sich auf die verschiedenen räumlichen Anordnungen, die ein Molekül aufgrund der Rotation um Einfachbindungen annehmen kann. Diese unterschiedlichen Konformationen resultieren aus der freien Drehbarkeit von Einfachbindungen und führen zu verschiedenen Strukturformen desselben Moleküls. Konformationelle Isomere haben daher unterschiedliche geometrische Formen, behalten aber dieselbe chemische Struktur bei.
Beispiele
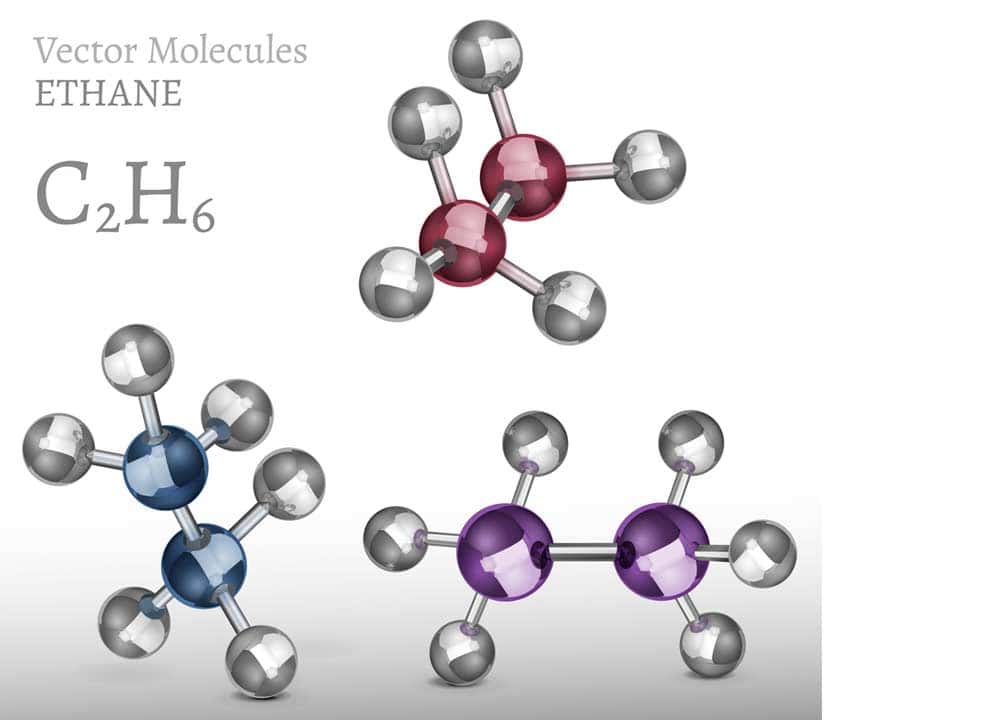
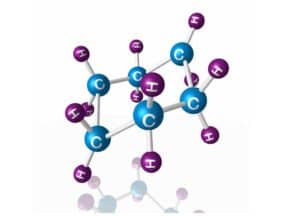
- Ein bekanntes Beispiel für konformationelle Isomerie ist das Ethanmolekül. Es kann in einer gestreckten oder gewinkelten Form existieren, da die Einfachbindung zwischen den beiden Kohlenstoffatomen frei drehbar ist.
- Auch das Cyclohexanmolekül zeigt konformationelle Isomerie aufgrund der Rotation um die Kohlenstoff-Kohlenstoff-Einfachbindungen in seinem Ring.
- Proteine können verschiedene konformationelle Isomere annehmen, die für ihre biologische Funktion entscheidend sind. Die Tertiärstruktur von Proteinen beruht auf der stabilsten Konformation.
- Konformationelle Isomerie tritt auch bei Alkanen auf, insbesondere bei längerkettigen Molekülen wie n-Hexan. Diese können verschiedene Stuhlkonformationen annehmen.
- Zucker wie Glucose können konformationelle Isomere bilden, da die hydroxylierten Kohlenstoffatome unterschiedliche räumliche Anordnungen haben.
- Auch bei biologischen Membranen können Lipidmoleküle verschiedene konformationelle Isomere annehmen, die ihre Interaktionen und Funktionen beeinflussen.
Überblick über Konformationelle Isomerie in organischen Molekülen
Konformationelle Isomerie ist ein faszinierendes Konzept, das die Flexibilität in Molekülen betrifft. Im Gegensatz zu anderen Formen der Isomerie, bei denen unterschiedliche Verbindungen durch verschiedene Arten kovalenter Bindungen entstehen, geht es bei der konformationellen Isomerie um Rotationsisomere. Diese entstehen durch die Rotation um einfach gebundene Kohlenstoff-Kohlenstoff-Bindungen.
Ein klassisches Beispiel für Konformationsisomere sind die sogenannten Gauche und Anti Isomere. Diese Unterschiede in der räumlichen Anordnung von Atomen oder Atomgruppen können erhebliche Auswirkungen auf die physikalischen und chemischen Eigenschaften eines Moleküls haben. Ein weiteres wichtiges Werkzeug zur Untersuchung von Konformationsisomeren ist die Newman Projektion, die es erlaubt, die relative Ausrichtung von Gruppen entlang einer C-C-Bindung visualisieren.
Die Analyse dieser Isomere kann mit Konzepten wie Sessel- und Wannenformen von Cyclohexan fortgesetzt werden. Beide stellen zwei wichtige Konformationen dar, wobei die Sesselkonformation energetisch günstiger ist aufgrund geringerer sterischer Hinderung.
Rotationen innerhalb von Molekülen führen zu verschiedenen Orientierungen, was als interne Rotation oder Rotationsisomerie bezeichnet wird. Dabei spielen auch Begriffe wie Staggered und Eclipsed Konformationen eine Rolle, welche sich in ihrer Energie unterscheiden. Die molaren Konformationsanalyse hilft dabei, diese energetischen Differenzen quantitativ zu erfassen.
Schlussendlich beeinflussen konformationelle Isomere direkt die chemische Reaktivität und die Wechselwirkungen zwischen Molekülen, insbesondere in biologischen Systemen wie Proteinen und Enzymen.
In jeder Molekülstruktur sind die kleinsten Veränderungen von größter Bedeutung. – Linus Pauling
| Begriff | Definition |
|---|---|
| Gauche Isomer | Eine Konformation bei der zwei substituenten in einem Torsionswinkel von etwa 60° zueinander stehen. |
| Anti Isomer | Eine Konformation bei der zwei substituenten in einem Torsionswinkel von 180° zueinander stehen. |
| Newman Projektion | Eine Darstellungsweise zur Visualisierung der relativen Ausrichtung von Gruppen entlang einer C-C-Bindung. |
| Sesselkonformation | Eine energetisch günstige Konformation eines Cyclohexanrings mit minimaler sterischer Hinderung. |
| Wannenform | Eine Konformation des Cyclohexanrings, die höhere sterische Spannung aufweist als die Sesselkonformation. |
| Staggered Konformation | Eine Konformation, bei der die Substituenten der benachbarten Kohlenstoffatome in einer gestaffelten Anordnung sind. |
| Eclipsed Konformation | Eine Konformation, bei der die Substituenten der benachbarten Kohlenstoffatome direkt übereinander stehen, was zu einer höheren Energie führt. |
Unterschiede zwischen verschiedenen Konformationsisomeren
Konformationelle Isomerie betrifft die verschiedenen Rotationsisomere, die durch Drehung um eine Einfachbindung entstehen können. Ein klassisches Beispiel ist das Ethan-Molekül, bei dem verschiedene Konformationen durch freie Rotation um die Kohlenstoff-Kohlenstoff-Bindung auftreten können.
In der Newman Projektion werden diese unterschiedlichen Konformationsisomere sichtbar gemacht. Typische Konformationen sind hierbei staggered (versetzt) und eclipsed (überlappend). Die staggered Konformation ist energetisch stabiler, da die Abstoßung zwischen den Elektronenpaaren minimiert wird, während die eclipsed Konformation höhere Energie besitzt aufgrund der größeren sterischen Hinderung.
Eine ähnliche Betrachtung gilt auch für Moleküle wie Butan, wo die Rotationsisomere als Gauche und Anti Isomere bekannt sind. In dieser Struktur gibt es zwei Gauche-Isomere mit einer Energiedifferenz, abhängig vom Abstand der Substituenten, und einen Anti-Isomer, das energetisch bevorzugt ist.
Ein weiteres Feld der konformationellen Isomerie finden wir in zyklischen Strukturen, etwa bei Cyclohexan. Hier zeigen sich die Unterschiede deutlich an den Sessel- und Wannenformen des Rings, wobei die Sessel-Konformation energetisch begünstigt ist.
Die Analysis dieser Isomeren umfasst oft Begriffe wie Konformerer Energie und benötigt häufig eine Molar Konformationsanalyse zur präzisen Bestimmung der Energiewerte und Stabilitäten der einzelnen Konformationen. Faktoren wie sterische Hinderung und interne Rotation spielen ebenfalls eine wesentliche Rolle bei der Bildung und Stabilität von Konformationsisomeren.
Energiebarrieren und Einfluss auf Isomerisierung
Die Konformationelle Isomerie ist oft mit Energiebarrieren verbunden, die die Umwandlung zwischen verschiedenen Konformationsisomeren beeinflussen. Diese Energiebarrieren resultieren aus der energetischen Differenz, die bei der internen Rotation um eine Einfachbindung entsteht.
Ein prominentes Beispiel sind die Staggered und Eclipsed Konformationen in Ethanmolekülen. Die Eclipsed-Konformation hat eine höhere Energie wegen sterischer Hinderung und elektronischer Abstoßung zwischen den Wasserstoffatomen. Im Gegensatz dazu ist die Staggered-Konformation energetisch günstiger. Die Höhe der Energiebarriere bestimmt, wie leicht das Molekül von einer Konformation zur anderen wechseln kann.
Der Unterschied in den Energien dieser Konformationen wird häufig mithilfe der Newman Projektion illustriert. Dabei wird gezeigt, dass die Gauche- und Anti-Isomere unterschiedliche Energien haben, was auf deren spezifische räumliche Anordnung zurückzuführen ist.
Die Sessel- und Wannenformen von Cyclohexan sind ein weiteres gutes Beispiel für unterschiedliche Energiestufen aufgrund konformer Veränderungen. Die Sesselkonformation ist stabiler als die Wannenform, was ebenfalls auf geringere sterische Wechselwirkungen zurückzuführen ist.
Zusammengefasst spielen diese Energiebarrieren eine wichtige Rolle bei der Flexibilität in Molekülen und beeinflussen maßgeblich chemische Reaktionen sowie molekulare Eigenschaften.
Einfluss von Konformationen auf chemische Reaktionen
Der Einfluss von Konformationen auf chemische Reaktionen ist ein zentrales Thema in der organischen Chemie. Die räumliche Anordnung der Atome in einem Molekül, also die Konformationelle Isomerie, kann maßgeblich bestimmen, wie und ob eine chemische Reaktion überhaupt abläuft. Zum Beispiel können unterschiedliche Konformere verschiedene Reaktivitäten zeigen, was auf ihre energetisch bevorzugten Zustände zurückzuführen ist.
In der Regel sind bestimmte Konformationen energetisch günstiger als andere. Diese Konformerer Energie bestimmt weitgehend, welche Konformation ein Molekül bevorzugt einnimmt und welche reaktiven Zentren zugänglich sind. Konformere mit hoher Energiebarriere wechseln weniger leicht zwischen verschiedenen Zuständen, was sich direkt auf die Geschwindigkeit einer Reaktion auswirkt.
Ein klassisches Beispiel hierfür findet man in der Cyclohexan-Chemie. Hier kann das Molekül zwischen Sessel- und Wannenformen umklappen. Während die „Sessel“-Form stabil und energetisch günstig ist, sind die „Wannen“-Formen deutlich reaktiver.
Darüber hinaus beeinflusst die sterische Hinderung durch voluminöse Gruppen ebenfalls die Reaktivität. In Gauche- und Anti-Isomeren unterscheiden sich die relativen Positionen von Substituenten. Diese Unterschiede führen zu variierenden Wechselwirkungen und Reaktionsgeschwindigkeiten. Beispielsweise ist die staggered-Konformation aufgrund geringerer sterischer Spannungen oft reaktiver als die eclipsed-Konformation.
Das Verständnis der konformen Vielfalt ermöglicht es Chemikern, gezielt Einfluss auf die Reaktionsbedingungen und -mechanismen zu nehmen.
Zusammengefasst ist es entscheidend, die Flexibilität in Molekülen bei der Planung chemischer Synthesen zu berücksichtigen. Ein Wissen über die stabilisierten Konformationen sowie deren Energielandschaften hat direkten praktischen Nutzen für die Optimierung und Vorhersage von chemischen Prozessen.
Methoden zur Bestimmung von Konformationsisomeren
In der organischen Chemie gibt es mehrere Methoden zur Bestimmung von Konformationsisomeren. Eine häufig genutzte Methode ist die Kernspinresonanzspektroskopie (NMR). Diese Technik ermöglicht es, die unterschiedlichen Energiezustände der Isomere zu erkennen und deren Populationen quantitativ zu bestimmen.
Ein weiteres nützliches Werkzeug ist die Röntgenkristallographie. Sie liefert detaillierte Informationen über die räumliche Anordnung von Atomen innerhalb eines Kristalls. Diese Methode eignet sich besonders gut für die Untersuchung von starren Konformationen, obwohl sie weniger effektiv bei flexiblen Molekülen ist.
Computergestützte Simulationsmethoden wie die Molekulardynamiksimulation können ebenfalls verwendet werden, um mögliche Konformationen zu modellieren und deren relative Energien abzuschätzen. Dies ist besonders nützlich bei komplexen Molekülen mit vielen Freiheitsgraden.
Eine weitere Technik ist das Infrarotspektroskopie, speziell im Bereich niedriger Frequenzen. Hierdurch lassen sich Bewegungen wie Drehungen und Biegungen identifizieren, was Aufschluss über verschiedene Konformationen gibt.
Elektronenmikroskopie kann auch eingesetzt werden, vor allem wenn präzise Strukturen überprüft werden müssen. Es gibt noch viele weitere spezialisierte Techniken, doch NMR und Röntgenkristallographie sind oft die gängigsten Methoden in der Praxis.
In Kombination können diese Methoden eine umfassende Sicht auf die konformationelle Vielfalt eines Moleküls bieten. So wird es möglich, sowohl die Struktur als auch die dynamische Flexibilität in Molekülen besser zu verstehen.
| Begriff | Beschreibung | Beispiel |
|---|---|---|
| Konformationelle Isomerie | Unterschiedliche räumliche Anordnung von Atomen in einem Molekül durch Rotation um Einfachbindungen. | Ethan hat mehrere Konformationen durch Rotation. |
| Rotationsisomerie | Isomerie, die durch freie Drehung um eine Einfachbindung entsteht. | Gauche- und Anti-Isomere von Butan. |
| Newman Projektion | Darstellungsmethode zur Visualisierung der Konformation eines Moleküls entlang einer Kohlenstoff-Kohlenstoff-Bindung. | Visualisierung von Rotationsisomeren in Ethan. |
Rolle der sterischen Hinderung bei Konformationsisomeren
Die sterische Hinderung spielt eine entscheidende Rolle bei der konformationellen Isomerie. Wenn Atome oder Atomgruppen im Raum um eine Einfachbindung rotieren, kann es zu energetisch ungünstigen Situationen kommen. Diese treten auf, wenn sich voluminöse Gruppen einander nähern und dadurch Abstoßungen durch Van-der-Waals-Kräfte entstehen.
Ein klassisches Beispiel hierfür sind die Gauche und Anti Isomere von Butan. In der Gauche-Konformation befinden sich zwei Methylgruppen in unmittelbarer Nähe zueinander, was zu signifikanter sterischer Hinderung führt. Hingegen vermeidet die Anti-Konformation diese Nähe, indem sie die Methylgruppen möglichst weit voneinander entfernt hält, wodurch diese Konformation energetisch bevorzugt ist.
Der Einfluss der sterischen Hinderung zeigt sich auch beim Cyclohexan, das zwischen verschiedenen Konformationen wie den Sessel- und Wannenformen wechseln kann. Die Sesselkonformation weist weniger sterische Spannungen auf und ist daher stabiler als die Wannenform. Diese Unterschiede sind deutlich in der energiebezogenen Analyse erkennbar, welche oft als Molaren Konformationsanalyse bezeichnet wird.
Durch die interne Rotation können Moleküle verschiedene Konformationen annehmen, wobei die Energieunterschiede durch die Größe und Position der beteiligten Gruppen bestimmt werden. Hierzu gehört auch die Unterscheidung von Staggered und Eclipsed Konformationen, wobei erstere aufgrund geringerer sterischer Hinderung bevorzugt ist.
Abschließend beeinflusst die sterische Hinderung direkt die Flexibilität in Molekülen und deren chemische Reaktivität. Die Kenntnis dieser Effekte ist essenziell für das Verständnis molekularer Strukturen und ihrer Funktionalität in der organischen Chemie.
Beispiele aus der Natur: Proteine und Enzyme
In der Natur spielt die konformationelle Isomerie eine Schlüsselrolle bei Proteinen und Enzymen. Proteine sind komplexe biologische Moleküle, deren Funktion stark von ihrer dreidimensionalen Struktur abhängt. Diese Struktur kann verschiedene konformationelle Zustände einnehmen, was als Protein-Faltung bekannt ist.
Eine besonders wichtige Rolle dabei spielen die Sessel- und Wannenformen bei Zuckern wie Glukose in Glykoproteinen. Aufgrund dieser Flexibilität können Proteine spezifische Bindungsstellen formen und auf ihre Umgebung reagieren. Diese verschiedenen Formen können durch Interne Rotation entlang der Peptidbindungen erreicht werden.
Enzyme, die als Biokatalysatoren wirken, nutzen ebenfalls konformationelle Isomerie, um ihre Aktivität zu regulieren. Ein klassisches Beispiel dafür ist das Konzept des „Induced Fit“, bei dem das Enzym seine Form ändert, um das Substrat optimal zu binden. Dies zeigt, wie die Rotationsisomerie und die daraus resultierenden Konformationsänderungen die katalytische Effizienz eines Enzyms steuern.
Die Flexibilität in Molekülen, insbesondere bei Proteinen und Enzymen, ermöglicht es ihnen, auf unterschiedliche molekulare Interaktionen angemessen zu reagieren. Diese Fähigkeit erhöht nicht nur die Anpassungsfähigkeit, sondern auch die Funktionalität der Moleküle erheblich.
Anwendung in der pharmazeutischen Chemie
Konformationelle Isomerie spielt eine wesentliche Rolle in der pharmazeutischen Chemie. Die Flexibilität in Molekülen, insbesondere in Wirkstoffmolekülen, beeinflusst deren Bindungsfähigkeiten und somit ihre Wirksamkeit.
Rotationsisomerie ermöglicht beispielsweise die Anpassung von Molekülen an verschiedene Enzymtaschen oder Rezeptorstellen im Körper. In diesem Kontext sind die Gauche- und Anti-Isomere von entscheidender Bedeutung, da sie zur spezifischen Anbindung an Zielstrukturen beitragen können.
Durch die Analyse der Newman-Projektion können Wissenschaftlerinnen die bevorzugten Sessel- und Wannenformen eines Moleküls bestimmen. Dies hilft bei der Entwicklung von Arzneimitteln, die stabilere Konformeren haben und dadurch effektiver wirken. Bei der Molaren Konformationsanalyse werden verschiedene Konformationen hinsichtlich ihrer Energie untersucht, um den energetisch günstigsten Zustand zu ermitteln.
Sterische Hinderung kann erheblichen Einfluss auf die Bioverfügbarkeit eines Wirkstoffs haben. Wenn intern die Rotation eingeschränkt wird, kann dies die Stabilität und die Effizienz des Wirkstoffs steigern.
Staggered- und Eclipsed-Konformationen können die Funktionsweise von Medikamenten sowie deren Nebenwirkungen stark beeinflussen. Ein besseres Verständnis dieser Konformationen kann also zu sichereren und wirksameren Medikamenten führen.
In der Entwicklung neuer Pharmazeutika ist die genaue Kenntnis über konformationelle Isomerie daher unverzichtbar. Nur so können innovative Wirkstoffe entdeckt und gezielt entwickelt werden.