Metallionen spielen eine zentrale Rolle in verschiedenen Bereichen wie Chemie, Biologie und Umweltwissenschaften. Der Nachweis von Metallionen ist daher von großer Relevanz für zahlreiche Anwendungen vom Labor bis zur industriellen Produktion.
Fällungsreaktionen sind eine der gängigsten Methoden zum Nachweis dieser Ionen. Sie basieren auf der Bildung unlöslicher Verbindungen, die als sichtbarer Niederschlag erscheinen. Durch diesen chemischen Prozess können verschiedene Metallionen effizient identifiziert werden.
Die Auswahl geeigneter Reagenzien ist entscheidend für den Erfolg einer Fällungsreaktion. Diese müssen spezifisch genug sein, um den gewünschten Niederschlag mit dem gesuchten Ion zu bilden, ohne unerwünschte Nebenreaktionen auszulösen.
Viele Metallionen lassen sich durch typische Beispielreaktionen nachweisen, bei denen präzise Bedingungen hinsichtlich pH-Wert, Konzentration und Temperatur eingehalten werden müssen. So erhält man verlässliche Ergebnisse, die oft auch quantitativ ausgewertet werden können, beispielsweise durch die Mohrsche Titration.
Abschließend erfordert die qualitative Analyse der Fällungsprodukte praktische Kenntnisse über mögliche Fehlerquellen. Dazu gehören etwa ungenaue Dosierung der Reagenzien oder Störungen durch Fremdionen. Ein zielgerichtetes Vorgehen minimiert solche Risiken und maximiert die Genauigkeit der Analysen.
Das Wichtigste in Kürze
- Fällungsreaktionen bilden unlösliche Niederschläge, um Metallionen sichtbar zu machen.
- Typische Metallionen: Eisen, Kupfer, Zink, Blei und Silber.
- Reagenzienwahl und pH-Wert entscheidend für spezifische Fällungen.
- Qualitative Analyse durch Farbe und Form der Niederschläge möglich.
- Fehlerquellen: Verunreinigungen, Temperatur- und Konzentrationsschwankungen.
Der Nachweis von Metallionen durch Fällungsreaktionen ist ein analytisches Verfahren in der chemischen Analytik, das zur Identifizierung von bestimmten Metallionen in einer Lösung verwendet wird. Bei dieser Methode wird eine Lösung des zu analysierenden Metallions mit einer Reagenzlösung versetzt, die ein Reagenz enthält, das mit dem Metallion reagieren und einen unlöslichen Niederschlag bilden kann. Die Bildung des Niederschlags zeigt den Nachweis des spezifischen Metallions an. Durch die Art des gebildeten Niederschlags kann auf das Vorhandensein und die Identität des Metallions geschlossen werden.
Beispiele
Ein Beispiel für den Nachweis von Metallionen durch Fällungsreaktionen ist der Nachweis von Silberionen (Ag^+) durch Zugabe von Chloridionen (Cl^-) in Form von Silbernitratlösung. Die Zugabe von Chloridionen führt zur Bildung von Silberchlorid (AgCl), einem unlöslichen Niederschlag, der den Nachweis von Silberionen anzeigt.
Ein weiteres Beispiel ist der Nachweis von Eisen(III)-Ion (Fe^3+) durch Zugabe von Hydroxidionen (OH^-), was zur Bildung von Eisen(III)-hydroxid (Fe(OH)3), einem unlöslichen Niederschlag, führt. Diese Fällungsreaktionen dienen zur Identifizierung und Quantifizierung von Metallionen in Lösungen.
Ein weiteres Beispiel für den Nachweis von Metallionen durch Fällungsreaktionen ist der Nachweis von Quecksilber(II)-Ion (Hg^2+) durch Zugabe von Iodidionen (I^-) in Form von Kaliumiodidlösung. Die Reaktion führt zur Bildung von Quecksilber(II)-iodid (HgI2), einem gelben Niederschlag, der den Nachweis von Quecksilberionen anzeigt. Diese Fällungsreaktionen sind wichtige analytische Verfahren zur Identifizierung und Bestimmung von Metallionen in Lösungen.
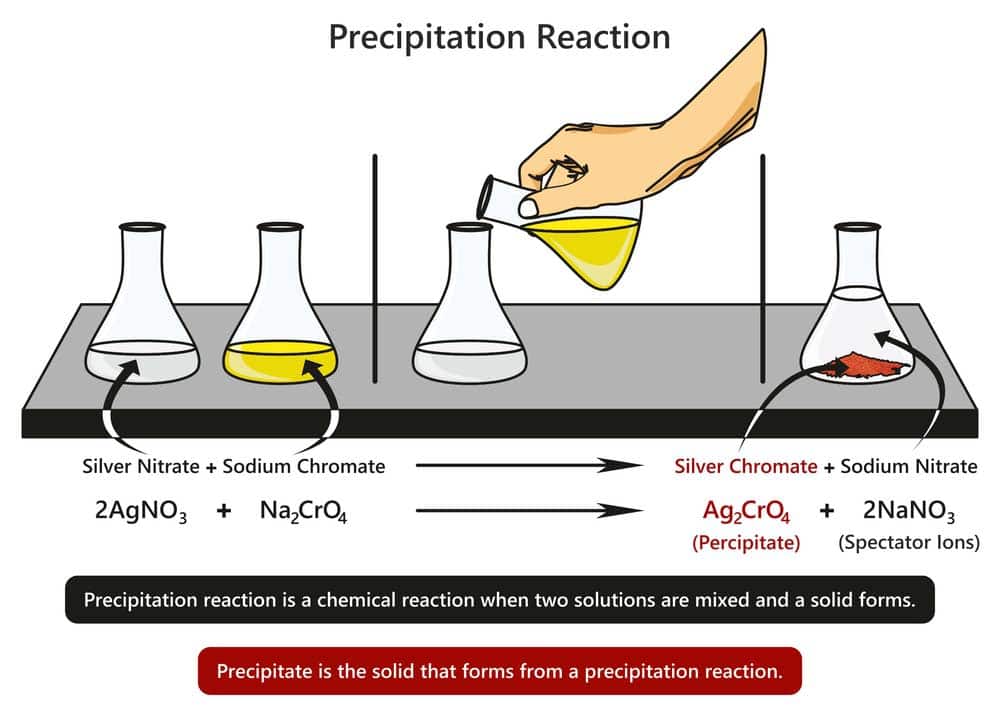
Die Reaktion zwischen Silbernitrat (AgNO3) und Natriumchromat (Na2CrO4) zur Bildung von Silberchromat (Ag2CrO4) und Natriumnitrat (NaNO3) ist ebenfalls ein Beispiel für eine Fällungsreaktion. In dieser Reaktion kommt es zur Bildung eines gelben Niederschlags von Silberchromat, was den Nachweis von Chromationen (CrO4^2-) ermöglicht. Fällungsreaktionen wie diese werden in der chemischen Analytik eingesetzt, um das Vorhandensein von bestimmten Ionen nachzuweisen.
Einführung wichtiger Metallionen und ihre Relevanz
Metallionen spielen eine zentrale Rolle in vielen Bereichen der Chemie und im täglichen Leben. Zu den häufigsten Metallionen gehören Eisen (Fe2+/Fe3+), Kupfer (Cu2+), Zink (Zn2+), Blei (Pb2+) und Silber (Ag+). Jede dieser Ionenarten besitzt charakteristische Eigenschaften, die sie für spezielle Anwendungen geeignet machen.
Eisenionen sind beispielsweise entscheidend für biochemische Prozesse wie den Sauerstofftransport im Blut durch Hämoglobin. Kupferionen finden sich häufig in elektrischen Leitungen wegen ihrer hervorragenden Leitfähigkeit und Korrosionsbeständigkeit.
Zink wird oft in der Galvanotechnik eingesetzt und ist ein wichtiger Bestandteil vieler Enzyme in biologischen Systemen. Blei hingegen hat aufgrund seiner gesundheitsschädlichen Wirkung an Bedeutung verloren, kommt aber noch immer in bestimmten Industriezweigen vor.
Silberionen zeichnen sich durch ihre antiseptischen Eigenschaften und werden daher in medizinischen Produkten sowie Wasseraufbereitung verwendet. Diese Beispiele zeigen, dass das Verständnis und der Nachweis von Metallionen durch chemische Methoden wie Fällungsreaktionen nicht nur wissenschaftlich interessant, sondern auch praktisch äußerst nützlich ist.
Chemische Reaktionen und der Nachweis von Metallionen bilden das Fundament vieler technologischer und wissenschaftlicher Fortschritte. – Dmitri Mendelejew
| Metallion | Anwendungsgebiet |
|---|---|
| Eisen (Fe2+/Fe3+) | Biochemische Prozesse, Sauerstofftransport im Blut |
| Kupfer (Cu2+) | Elektrische Leitungen, Korrosionsschutz |
| Zink (Zn2+) | Galvanotechnik, Enzyme in biologischen Systemen |
| Blei (Pb2+) | Industriezweige, historische Verwendung |
| Silber (Ag+) | Medizinische Produkte, Wasseraufbereitung |
Prinzip der Fällungsreaktionen und chemische Grundlagen
Das Prinzip der Fällungsreaktionen basiert auf der Bildung schwerlöslicher Verbindungen, die sich als Feststoff (Niederschlag) aus einer Lösung abscheiden. Wenn eine Lösung ein bestimmtes Metallion enthält und ein geeignetes Reagenz hinzugefügt wird, reagiert das Metallion mit dem Reagenz zu einem schwerlöslichen Salz.
Zum Beispiel bildet Silberion (Ag+) mit Chloridionen (Cl–) Silberchlorid (AgCl), welches als weißer Niederschlag erscheint. Diese Art von Reaktionen ist nützlich, da sie eindeutige Hinweise auf das Vorhandensein spezifischer Metallionen geben können.
Ein grundlegendes Verständnis der Löslichkeitsprodukte (Ksp-Werte) ist hierbei essenziell. Dieses Produkt gibt an, wie stark ein Stoff in Lösung gehen kann, bevor er zu einem Niederschlag führt. Je kleiner der Ksp-Wert, desto weniger löslich ist das entsprechende Salz und desto schneller bilden sich Feststoffe.
Die Wahl des richtigen Reagenz hängt von den chemischen Eigenschaften des gesuchten Metallions sowie den möglichen Interferenzen anderer Ionen ab. In einigen Fällen müssen mehrere Schritte durchgeführt werden, um einen klaren Nachweis zu gewährleisten, zum Beispiel durch das Entfernen störender Ionen vor der eigentlichen Fällung.
Insgesamt ermöglichen diese Reaktionen einen visuellen und qualitativen Nachweis von Metallionen, welcher besonders in der analytischen Chemie geschätzt wird.
Auswahl geeigneter Reagenzien für Fällungsreaktionen
Die Auswahl der Reagenzien für Fällungsreaktionen spielt eine zentrale Rolle bei der zuverlässigen Identifikation von Metallionen. Um geeignete Reagenzien auszuwählen, müssen Chemiker die spezifischen Eigenschaften der zu untersuchenden Metallionen sowie die möglichen Reaktionsprodukte berücksichtigen.
Ein wichtiger Aspekt ist die Löslichkeit der entstehenden Verbindungen. Nur wenn das gebildete Fällungsprodukt schwer löslich ist, kann eine klare Trennung und somit Nachweisbarkeit gewährleistet werden. Typische Reagenzien sind Ionen oder Moleküle, die mit den Metallionen stabile und wenig lösliche Salze bilden. Ein klassisches Beispiel ist die Verwendung von Natriumsulfid zur Fällung von Blei(II)-Ionen als Blei(II)-sulfid.
In vielen Fällen sind auch Spezifitätsreagenzien nötig. Diese reagieren nur mit bestimmten Metallionen und nicht mit anderen in der gleichen Lösung vorhandenen Stoffen. Chelatbildner wie EDTA (Ethylendiamintetraessigsäure) können ebenfalls eingesetzt werden, da sie besonders stabile Komplexe mit bestimmten Ionen bilden.
Betrachtet man die verschiedenen Reagenzien weiter, so spielen Aspekte wie Konzentration und pH-Wert eine entscheidende Rolle. Der pH-Wert der Lösung kann beeinflussen, welche Spezies in Lösung vorliegt. Beispielsweise fällt Eisen(III)-hydroxid besser aus einer basischen Lösung als aus einer sauren heraus.
Mit diesen Kriterien im Hinterkopf kann gezielt ein Reagenz ausgewählt werden, um gewünschte Fällungen und damit die Identifikation bestimmter Metallionen durchführen zu können.
Durchführung und Beobachtung der Fällungsprozesse
Um Fällungsprozesse durchzuführen, bereitet man zunächst eine Lösung des Metallsalzes vor. Als nächstes gibt man schrittweise ein geeignetes Fällungsreagenz hinzu. Dabei muss die Zugabe langsam und unter stetigem Rühren erfolgen, um eine gleichmäßige Verteilung zu gewährleisten.
Während der Reaktion beobachtet man die Veränderungen in der Lösung. Häufig sieht man nach einer Weile kleine Partikel oder Flocken entstehen, die sich als Fällungsprodukt niederschlagen. Diese sind oft farbig und erlauben damit eine erste qualitative Analyse. Die Farbe und Form der Niederschläge können Hinweise auf das jeweilige Metallion geben.
Nach Auftreten des Fällungsprodukts lässt man die Mischung einige Zeit stehen, damit sich der Niederschlag vollständig absetzen kann. In manchen Fällen kann es hilfreich sein, die Suspension zu filtrieren oder abzudekantieren, um den festen Stoff vom überstehenden Klarwasser zu trennen.
Beachte, dass bei der Arbeit mit Fällungsreaktionen immer sauberes Laborgeschirr verwendet werden sollte, um Kreuzkontamination zu vermeiden. Zudem ist es empfehlenswert, unterschiedliche Tests zeitlich nacheinander durchzuführen, falls ähnliche Fällungsprodukte erwartet werden.
Anschließend wird der Niederschlag möglicherweise gewaschen und getrocknet, um ihn für weiterführende analytische Methoden vorzubereiten. Eine saubere Durchführung und genaue Beobachtung sind entscheidend, um verlässliche Resultate zu erzielen.
Identifikation von Metallionen durch Fällungsprodukte
Die Identifikation von Metallionen basiert auf der Beobachtung spezifischer Fällungsprodukte. Diese Produkte entstehen, wenn bestimmte Reagenzien mit den Metallionen reagieren und unlösliche Verbindungen bilden. Die Farbe, Form und das Aussehen der Fällungsprodukte sind oft charakteristisch für das jeweilige Metallion.
Beispielsweise bildet Silber mit Chlorid-Ionen einen weißen, käsigen Niederschlag von Silberchlorid (AgCl). Kupfer hingegen ergibt mit Hydroxid-Ionen einen blauen, gallertartigen Niederschlag von Kupferhydroxid. Solche markanten Unterschiede in der Erscheinung ermöglichen eine eindeutige Zuordnung der Metallionen zu ihren Fällungsprodukten.
Weitere typische Beispiele umfassen die Entstehung von süßlichem Eisensulfid bei der Reaktion von Eisen(II)-Ionen mit Sulfid-Ionen sowie den leuchtend gelben Niederschlag von Blei(II)-iodid beim Mischen von Blei(II)-Ionen mit Iodid-Ionen. Das visuelle Erkennen dieser Fällungen erfordert Erfahrung und Aufmerksamkeit, um Verwechslungen auszuschließen.
Zur Bestätigung der Identität kann man ergänzende analytische Methoden verwenden, wie Mohrsche Titration oder spektroskopische Analysen. Diese präziseren Techniken bieten zusätzliche Sicherheit bei der Identifikation der Metallionen. Indem sie sowohl sichtbare Merkmale als auch chemische Eigenschaften nutzen, erlauben sie eine genaue Bestimmung der beteiligten Ionen.
| Metallion | Reagenz | Niederschlag |
|---|---|---|
| Silber (Ag+) | Chlorid-Ionen (Cl–) | Weißes Silberchlorid (AgCl) |
| Kupfer (Cu2+) | Hydroxid-Ionen (OH–) | Blaues Kupferhydroxid (Cu(OH)2) |
| Blei (Pb2+) | Iodid-Ionen (I–) | Gelbes Bleiiodid (PbI2) |
Beispielreaktionen für typische Metallionen
Eine typische Fällungsreaktion zur Nachweis von Silber-Ionen (Ag+) erfolgt durch Zugabe einer Chloridquelle wie z.B. Natriumchlorid (NaCl) oder Salzsäure (HCl). Dabei bildet sich ein weißer Niederschlag von Silberchlorid (AgCl). Diese Reaktion ist schnell und deutlich sichtbar, was sie ideal für den qualitativen Nachweis macht.
Ein weiteres Beispiel ist der Nachweis von Barium-Ionen (Ba2+). Hierbei wird Schwefelsäure (H2SO4) oder eine lösliche Sulfatverbindung zugegeben. Es entsteht ein weißer, schwerlöslicher Niederschlag von Bariumsulfat (BaSO4), der charakteristisch für Barium-Ionen ist.
Zum Nachweis von Kupfer(II)-Ionen (Cu2+) kann man Natriumhydroxid (NaOH) verwenden. Beim Kontakt bildet sich ein blauer Niederschlag von Kupfer(II)-hydroxid (Cu(OH)2). Dieser Blauton ist einzigartig und hilft bei der eindeutigen Identifizierung von Kupfer.
Diese Reaktionen sind nicht nur aufgrund ihrer Sichtbarkeit nützlich; sie bieten auch Einblick in die chemischen Eigenschaften der verschiedenen Metallionen. Zudem können durch das Untersuchen der entstehenden Fällungsprodukte Rückschlüsse auf deren Struktur und Zusammensetzung gezogen werden.
Die Mohrsche Titration kann ebenfalls verwendet werden, um bestimmte Ionen exakt zu quantifizieren. Sie basiert auf Redoxreaktionen und ist besonders hilfreich im Bereich der analytischen Chemie.
Beachten Sie bei der Durchführung dieser Experimente immer die Sicherheitshinweise und arbeiten Sie sorgfältig, um genaue Ergebnisse zu erzielen.
Methoden zur qualitativen Analyse der Fällungsprodukte
Um die Fällungsprodukte qualitativ zu analysieren, spielen verschiedene Methoden eine Rolle. Eine gängige Methode ist die Mikroskopie, bei der die Form und Größe der Kristalle unter dem Mikroskop untersucht werden. Diese Eigenschaften können auf bestimmte Metallionen hindeuten.
Eine weitere Methode ist das Flammenfärbungs-Test, bei dem die Farbe der Flamme Hinweise auf die Identität des Metallions geben kann. Zum Beispiel färben Kupferionen die Flamme grün, während Kaliumionen eine violette Flammenfarbe erzeugen.
Chemische Tests mit spezifischen Reagenzien können ebenfalls nützlich sein. Hierbei wird ein kleines Stück des Fällungsprodukts in einer Lösung aufgelöst und anschließend ein spezifisches Reagenz hinzugefügt. Die entstehende Farbänderung oder zusätzliche Fällung gibt einen weiteren Hinweis auf die Anwesenheit bestimmter Metallionen.
Die Dünnschichtchromatographie (TLC) ist eine Methode zur Trennung und Identifikation von Stoffgemischen. Dabei wandert das Fällungsprodukt durch ein Medium, wodurch es separiert wird. Danach werden die getrennten Komponenten mit geeigneten Nachweisreagentien sichtbar gemacht.
Zusätzlich ist die Löslichkeit in verschiedenen Lösungsmitteln von Bedeutung. Unterschiedliche Metallionen haben unterschiedliche Löslichkeiten, was zur eindeutigen Bestimmung beitragen kann.
Abschließend lässt sich sagen, dass durch Kombination mehrerer dieser Analyseverfahren eine genaue Identifizierung der Metallionen im Fällungsprodukt möglich ist und dadurch viele Anwendungsmöglichkeiten entstehen könnten.
Einschränkungen und mögliche Fehlerquellen bei Fällungsreaktionen
Bei der Durchführung von Fällungsreaktionen sind einige Einschränkungen und Fehlerquellen zu beachten. Eine wichtige Einschränkung ist, dass Fällungsreaktionen oft nicht absolut spezifisch für ein Metallion sind. Verschiedene Metallionen können ähnliche Fällungsprodukte bilden oder sich sehr ähnlich verhalten, was die Identifikation erschweren kann.
Eine weitere Fehlerquelle liegt in der Konzentration und Reinheit der Reagenzien. Verunreinigungen können unerwünschte Nebenreaktionen hervorrufen, die das Ergebnis verfälschen. Auch die Konzentration des Analyts spielt eine große Rolle: Zu niedrige Konzentrationen können dazu führen, dass das Fällungsprodukt nicht sichtbar wird, während bei zu hohen Konzentrationen sämtliche Ionen ausfallen, was ebenfalls die Identifikation erschwert.
Die Temperatur des Reaktionsmediums beeinflusst ebenfalls die Ergebnisse von Fällungsreaktionen. Höhere Temperaturen erhöhen oft die Löslichkeit des Fällungsprodukts, wodurch dieses schlechter sichtbar wird. Umgekehrt können niedrigere Temperaturen die Reaktionsgeschwindigkeit verringern und zu unvollständigen Fällungen führen.
Zusammen mit diesen physikalischen Parametern sollten auch die Lagerbedingungen und die Lichtempfindlichkeit einiger Fällungsprodukte berücksichtigt werden. Ungünstige Lagerbedingungen könnten Farbänderungen oder Zersetzungen hervorrufen.
Schließlich spielen zeitliche Faktoren eine Rolle. Die beobachtete Farbe oder Konsistenz des Fällungsprodukts kann sich im Laufe der Zeit verändern, weshalb es wichtig ist, Beobachtungen unmittelbar nach der Reaktion vorzunehmen. Kritisch ist daher auch das richtige Timing in Bezug auf die Mohrsche Titration zur Bestimmung genauer Mengen an Chlorid, da hier eine ähnliche Problematik auftreten kann.