Chemische Reaktion erklärt
Eine chemische Reaktion ist ein grundlegender Stoffumwandlungsprozess, bei dem die chemischen Zusammensetzungen von Stoffen verändert werden. Dies führt zur Bildung neuer chemischer Verbindungen mit unterschiedlichen Eigenschaften im Vergleich zu den ursprünglichen Substanzen.
Während der Reaktion kommt es zu einer komplexen Atomumgruppierung, wobei Bindungsbildung und -spaltung zentrale Rollen spielen. Dieser Prozess wird oft durch sichtbare Merkmale wie Farbänderungen oder Gasentwicklung begleitet und beinhaltet typische Kennzeichen wie Energieabsorption und Energiefreisetzung.
Die beteiligten Ausgangsstoffe, auch als Reaktanten bezeichnet, reagieren zu neuen Endprodukten, wobei das Gesetz der Erhaltung der Masse stets gilt. Ein weiterer wichtiger Aspekt ist der Einfluss von Temperatur, Druck und spezifischen Katalysatoren, die eine exotherme oder endotherme Reaktion beschleunigen können.
Das Wichtigste in Kürze
- Chemische Reaktionen ändern die Zusammensetzung von Stoffen und erzeugen neue Verbindungen durch Bindungsbildung und -spaltung.
- Energieaustausch: exotherme Reaktionen setzen Energie frei, endotherme Reaktionen absorbieren Energie.
- Gesetz der Erhaltung der Masse: Die Gesamtmasse bleibt bei chemischen Reaktionen konstant.
- Faktoren wie Temperatur, Druck und Katalysatoren beeinflussen die Reaktionsgeschwindigkeit.
- Sichtbare Zeichen wie Farbänderungen oder Gasentwicklung signalisieren chemische Reaktionen.
Eine chemische Reaktion ist ein Prozess, bei dem Ausgangsstoffe (Edukte) durch chemische Umwandlungen in neue Stoffe (Produkte) überführt werden. Dabei werden Bindungen gebrochen und neu gebildet, wodurch sich die Eigenschaften der beteiligten Substanzen verändern. Chemische Reaktionen können von äußeren Einflüssen wie Temperatur, Druck oder Katalysatoren beeinflusst werden.
Änderung der chemischen Zusammensetzung von Stoffen
Eine chemische Reaktion führt zur Änderung der chemischen Zusammensetzung von Stoffen. Dies bedeutet, dass die beteiligten Substanzen ihre ursprüngliche Struktur verlassen und neue chemische Verbindungen bilden. Ein anschauliches Beispiel ist die Verbrennung von Wasserstoffgas (H2) mit Sauerstoffgas (O2), wobei Wassermoleküle (H2O) entstehen. Hierbei erfolgt eine Atomumgruppierung, bei der die Atome der Reaktanten neu miteinander kombiniert werden.
Während dieses Prozesses gibt es zwei Hauptphasen: Die bestehende Bindungen in den Reaktanten werden gespalten, und anschließend neue Bindungen zur Bildung der Produkte geschaffen. Dieses Phänomen wird als Bindungsbildung und Bindungsspaltung bezeichnet.
Ein zentraler Aspekt ist dabei auch der Energieaustausch, der während der Umwandlung stattfindet. Je nach Art der Reaktion kann Energie entweder absorbiert (endotherme Reaktion) oder freigesetzt (exotherme Reaktion) werden. Beispielsweise wird bei der Photosynthese Lichtenergie absorbiert, um Glukosemoleküle zu synthetisieren.
Chemische Reaktionen sind daher mehr als nur einfache stoffliche Veränderungen; sie beinhalten komplexe Prozesse der Molekülveränderung. Diese strukturellen Transformationen führen zu neuen physikalischen und chemischen Eigenschaften der resultierenden Produkte.
Da chemische Reaktionen einen so tiefgreifenden Einfluss auf die Eigenschaften der resultierenden Stoffe haben, sind sie ein zentrales Thema in Chemie und Technik.
„Chemische Reaktionen sind echte Umwandlungen der Materie, die neue Substanzen und neue Eigenschaften hervorbringen.“ – Marie Curie
| Reaktionstyp | Beschreibung |
|---|---|
| Exotherme Reaktion | Energie wird als Wärme freigesetzt, z.B. Verbrennung von Benzin. |
| Endotherme Reaktion | Energie wird absorbiert, z.B. Photosynthese in Pflanzen. |
| Redoxreaktion | Elektronen werden von einem Reaktanten auf einen anderen übertragen. |
| Neutralisationsreaktion | Eine Säure reagiert mit einer Base, um Wasser und Salz zu bilden. |
| Fällungsreaktion | Zwei Lösungen reagieren, um einen unlöslichen Feststoff (Niederschlag) zu bilden. |
Bildung neuer chemischer Verbindungen
Eine zentrale Eigenschaft chemischer Reaktionen ist die Bildung neuer chemischer Verbindungen. Dieser Prozess beinhaltet die Umwandlung von Stoffen, bei der Atome aus den ursprünglichen Molekülen neu angeordnet, kombinier- und getrennt werden. Durch diese Atomumgruppierung entstehen neue Substanzen, die sogenannte Produkte, im Gegensatz zu den anfänglichen Substanzen, bekannt als Reaktanten.
Dieser Stoffumwandlungsprozess umfasst sowohl die Bindungsbildung als auch die Bindungsspaltung zwischen den beteiligten Atomen. Typische chemische Vorgänge wie die Bildung von Wasser aus Wasserstoff und Sauerstoff sind klassische Beispiele für eine solche Umwandlung. Hierbei verbinden sich zwei Wasserstoffmoleküle (H2) mit einem Sauerstoffmolekül (O2), um zwei Wassermoleküle (H2O) zu bilden.
Die Energieänderung spielt eine wesentliche Rolle in diesen Reaktionen. Chemische Umwandlungen können entweder exotherm sein und Energie freisetzen oder endotherm sein und Energie aufnehmen. Die Exotherme Reaktion setzt dabei öfters Energie frei, während die Endotherme Reaktion Energie absorbiert. Ein Katalysator kann diese Prozesse beschleunigen, indem er die benötigte Aktivierungsenergie senkt, ohne selbst verbraucht zu werden.
Zusätzlich beeinflussen äußere Bedingungen wie Temperatur und Druck sowie die Konzentration der Reaktanten die Reaktionsgeschwindigkeit maßgeblich. Insgesamt führt die chemische Umwandlung zur Bildung von neuen Verbindungen und stellt einen fundamentalen Aspekt vieler natürlicher und industrieller Prozesse dar.
Beispiele:
- Die Verbrennung von Methan (CH4) zu Kohlendioxid (CO2) und Wasser (H2O)
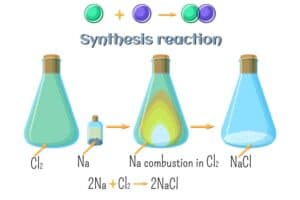
- Die Reaktion von Natrium (Na) mit Chlor (Cl2) zu Natriumchlorid (NaCl)
- Die Oxidation von Eisen (Fe) zu Eisenoxid (Fe2O3)
- Die Esterbildung zwischen Essigsäure und Ethanol zu Ethylacetat
- Die Neutralisationsreaktion von Salzsäure (HCl) mit Natronlauge (NaOH) zu Natriumchlorid (NaCl) und Wasser (H2O)
Energieaustausch während der Reaktion
Während einer chemischen Reaktion findet ein Energieaustausch statt, der in zwei verschiedene Kategorien unterteilt werden kann: exotherme und endotherme Reaktionen. Bei einer exothermen Reaktion wird Energie freigesetzt, oft in Form von Wärme oder Licht. Ein klassisches Beispiel hierfür wäre die Verbrennung von Holz, wo Wärme deutlich spürbar ist.
Im Gegensatz dazu absorbieren endotherme Reaktionen Energie aus ihrer Umgebung, was meist einen Temperaturabfall zur Folge hat. Ein Beispiel für eine endotherme Reaktion ist das Auflösen von Ammoniumnitrat in Wasser, bei dem sich die Lösung abkühlt.
Der Energieaustausch ist unvermeidlich mit der Umwandlung von Stoffen verbunden. Während chemischer Vorgänge finden Bindungsbildungen und -spaltungen statt, die entweder Energie benötigen oder freisetzen. Diese Energieänderung ist entscheidend dafür, ob eine Reaktion spontan verläuft.
Außerdem hängt die Menge an freigesetzter oder absorbierter Energie von den beteiligten Stoffen, genauer gesagt den Reaktanten und Produkten, ab. Durch diese Wechselwirkungen kommt es zur Molekülveränderung und damit zur Redoxreaktion oder auch Stickstoffarmen Reaktion.
Ein weiterer wichtiger Aspekt ist die Beteiligung eines Katalysators. Obwohl ein Katalysator selbst keine dauerhafte Veränderung erfährt, beschleunigt er die Reaktionsgeschwindigkeit, indem er die notwendige Aktivierungsenergie senkt. Dies beeinflusst sowohl exotherme als auch endotherme Reaktionen maßgeblich.
Zusammenfassend lässt sich sagen, dass der Energieaustausch ein zentrales Merkmal jeder chemischen Reaktion darstellt, unabhängig davon, ob Energie aufgenommen oder abgegeben wird.
Erhalt der Masse gemäß dem Gesetz
In einer chemischen Reaktion bleibt die Gesamtmasse der beteiligten Stoffe konstant. Dieses Prinzip ist als Gesetz der Erhaltung der Masse bekannt und wurde erstmals von Antoine Lavoisier im 18. Jahrhundert beschrieben. Das bedeutet, dass die Summe der Massen der Reaktanten gleich der Summe der Massen der Produkte ist.
Während der Reaktion kommt es zu keiner Schaffung oder Zerstörung von Materie. Vielmehr werden Atome lediglich neu angeordnet, was als Atomumgruppierung bezeichnet wird. So entstehen neue chemische Bindungen zwischen den Atomen, wobei die ursprünglichen Bindungen gespalten und neue gebildet werden.
Ein einfaches Beispiel dafür ist die Verbrennung von Methan (CH₄). Wenn Methan mit Sauerstoff reagiert, entstehen Kohlendioxid und Wasser. Die gesamte Masse der Produkte – Kohlendioxid und Wasser – entspricht genau der Masse der Ausgangsstoffe, Methan und Sauerstoff. Diese konstante Masse ist ein wesentlicher Aspekt jeder chemischen Umwandlung und hilft dabei, das Verständnis über den Verlauf einer chemischen Reaktion zu vertiefen.
Das Gesetz der Erhaltung der Masse spielt auch bei der Bestimmung der Reaktionsgeschwindigkeit eine Rolle, da es sicherstellt, dass keine Masse verloren geht, während die Konzentrationen der Reaktanten überwacht werden, um die Geschwindigkeit der chemischen Vorgänge zu bestimmen.
Das Gesetz des Erhalts der Masse besagt, dass bei chemischen Reaktionen die Gesamtmasse der Edukte gleich der Gesamtmasse der Produkte ist. Dies bedeutet, dass keine Masse verloren geht oder erzeugt wird während einer chemischen Reaktion. Das Gesetz spielt eine fundamentale Rolle, da es die Grundlage für das Verständnis von Reaktionen und die Berechnung von Stoffmengen bildet.
| Reaktionstyp | Merkmale | Beispiele |
|---|---|---|
| Synthesereaktion | Zwei oder mehr Substanzen verbinden sich zu einer neuen Verbindung | 2H2 + O2 → 2H2O |
| Analyse-/Zersetzungsreaktion | Eine Substanz wird in zwei oder mehr einfachere Substanzen zerlegt | 2H2O → 2H2 + O2 |
| Substitutionsreaktion | Ein Atom oder eine Atomgruppe in einer Verbindung wird durch ein anderes Atom oder eine Atomgruppe ersetzt | CH4 + Cl2 → CH3Cl + HCl |
Einfluss von Temperatur, Druck, Katalysatoren
Der Einfluss von Temperatur, Druck und Katalysatoren auf eine chemische Reaktion ist erheblich und variiert je nach der Art der Reaktion. Temperatur kann die Reaktionsgeschwindigkeit drastisch beeinflussen. Eine Erhöhung der Temperatur führt in vielen Fällen zu einer schnelleren Reaktionsrate, da die Moleküle mehr kinetische Energie haben und daher häufiger und effektiver zusammenstoßen können.
Druck, besonders bei gasförmigen Reaktanten, spielt ebenfalls eine wichtige Rolle. Ein Anstieg des Drucks konzentriert die Reaktanten auf ein kleineres Volumen, was die Wahrscheinlichkeit erhöht, dass sie miteinander kollidieren und reagieren. Dies kann insbesondere bei Gasreaktionen entscheidend sein, wie man es häufig bei der Synthese von Ammoniak durch das Haber-Bosch-Verfahren sieht.
Katalysatoren sind spezifische Substanzen, die die Reaktion beschleunigen, ohne dabei selbst verbraucht zu werden. Sie wirken, indem sie den Aktivierungsenergie-Bereich der Reaktanten senken, wodurch die Reaktion schneller ablaufen kann. Die Rolle eines Katalysators zeigt sich deutlich in biologischen Systemen, wo Enzyme als spezialisierte Katalysatoren agieren, um lebenswichtige biochemische Prozesse zu ermöglichen bzw. zu beschleunigen. In der Industrie finden Katalysatoren Anwendung bei der Herstellung von Kunststoffen, Treibstoffen und anderen wichtigen Chemikalien.
Die Kombination von Temperatur, Druck und Katalysatorentechnologie beeinflusst maßgeblich die Effizienz und Durchführbarkeit vieler chemischer Vorgänge.
| Einflussfaktor | Auswirkung auf chemische Reaktionen |
|---|---|
| Temperatur | – Höhere Temperaturen führen oft zu schnelleren Reaktionsraten, da die Teilchen mehr Energie haben und häufiger zusammenstoßen. – Bei niedrigen Temperaturen verlaufen Reaktionen langsamer und können sogar zum Stillstand kommen. |
| Druck | – Bei gasförmigen Reaktionen kann ein erhöhter Druck die Reaktionsgeschwindigkeit erhöhen, da die Gasmoleküle enger zusammenstoßen und häufiger kollidieren. – Bei nicht gasförmigen Reaktionen hat der Druck normalerweise keinen Einfluss. |
| Katalysatoren | – Katalysatoren können Reaktionsgeschwindigkeiten erhöhen, indem sie alternative Reaktionswege mit niedrigerer Aktivierungsenergie ermöglichen. – Sie beeinflussen die Reaktionsprodukte nicht und werden während der Reaktion nicht verbraucht. |
Umkehrbare und irreversible Reaktionen
Ein zentraler Aspekt chemischer Reaktionen ist die Frage, ob sie umkehrbar oder irreversibel sind. Umkehrbare Reaktionen können unter bestimmten Bedingungen wieder in ihre ursprünglichen Reaktanten zerlegt werden. Beispielsweise lässt sich das bei vielen Gleichgewichtsreaktionen beobachten, bei denen sich die Produkte und Reaktanten in einem dynamischen Gleichgewicht befinden.
Bei einer umkehrbaren Reaktion starten sowohl die Hin- als auch die Rückreaktion, sobald die Produkte gebildet werden. Typisch für diese Art der Reaktion ist das chemische Gleichgewicht, ein Zustand, bei dem die Geschwindigkeiten der Hin- und Rückreaktion gleich sind und sich somit die Konzentrationen von Reaktanten und Produkten nicht mehr ändern.
Beispiele für umkehrbare Reaktionen:
- Die Bildung von Wasser (H2O) aus Wasserstoff (H2) und Sauerstoff (O2)
- Die Bildung von Ammoniak (NH3) durch die Reaktion von Stickstoff (N2) und Wasserstoff (H2)
- Die Umwandlung von Kohlendioxid (CO2) und Wasser (H2O) zu Kohlensäure (H2CO3)
Irreversible Reaktionen hingegen laufen nur in eine Richtung ab. Ein typisches Beispiel hierfür ist die Verbrennung von Stoffen wie Holz oder Benzin. Sobald die Brennstoffe verbrannt sind, lassen sich die erzeugten Gase und andere Produkte nicht ohne Weiteres wieder zu den ursprünglichen Reaktanten zurückführen.
Sowohl umkehrbare als auch irreversible Reaktionen spielen wichtige Rollen im täglichen Leben und in industriellen Prozessen. Umkehrbare Reaktionen ermöglichen es wissenschaftlichen und technischen Anwendungen, effiziente Systeme und Zyklen zu entwickeln. Irreversible Reaktionen bieten oft eine direkte Umwandlung von Energie, was sie für viele praktische Anwendungen besonders nützlich macht.
Beispiele für irreversible Reaktionen:
- Die Verbrennung von Methan (CH4) zu Kohlendioxid (CO2) und Wasser (H2O)
- Die Reaktion von Natrium (Na) mit Chlor (Cl2) zu Natriumchlorid (NaCl)
- Die Oxidation von Eisen (Fe) zu Eisenoxid (Fe2O3)
Reaktionsgeschwindigkeit beeinflusst durch Konzentrationen
Die Reaktionsgeschwindigkeit ist ein wesentlicher Aspekt chemischer Vorgänge und wird maßgeblich durch die Konzentrationen der reagierenden Substanzen beeinflusst. Eine Erhöhung der Konzentration der Reaktanten führt in der Regel zu einer schnelleren Reaktion, weil mehr Teilchen für Kollisionen verfügbar sind, was die Wahrscheinlichkeit erhöht, dass sich diese bei genügend Energie verbinden.
Eine erhöhte Konzentration kann außerdem dazu führen, dass häufiger genug Energie vorhanden ist, um bestehende Bindungen aufzubrechen und neue zu bilden. Dies beschleunigt den Prozess der Bindungsbildung und Bindungsspaltung, welche zentrale Schritte einer chemischen Umwandlung darstellen.
Das Konzept lässt sich oft anschaulich anhand von Beispielen wie der Verbrennung von Benzin verdeutlichen. Bei höheren Sauerstoffkonzentrationen brennt das Benzin schneller und effizienter ab, da mehr Sauerstoffmoleküle zur Verfügung stehen, um mit den Brennstoffmolekülen zu reagieren.
Ein weiteres Beispiel ist die Rolle eines Katalysators. Obwohl dieser keine direkte Konzentrationsänderung darstellt, erhöht er die effektive Konzentration der reaktiven Zwischenstufen, was die Geschwindigkeit ebenfalls beeinflusst.
Somit spielt die Konzentration eine zentrale Rolle im Stoffumwandlungsprozess. Durch gezielte Anpassung der Konzentrationen lassen sich chemische Reaktionen steuern und optimieren – eine wichtige Anwendung in der industriellen Chemie.
Sichtbare Zeichen wie Farbänderungen, Gasentwicklung
Ein äußerst wichtiger Aspekt einer chemischen Reaktion sind die sichtbaren Zeichen, die darauf hinweisen, dass eine Umwandlung von Stoffen stattfindet. Diese Merkmale können sehr vielfältig sein und bieten oft den ersten Hinweis auf die chemischen Vorgänge, die ablaufen.
Farbänderungen sind ein häufiges Kennzeichen einer solchen Reaktion. Wenn Sie beispielsweise eine Pufferlösung zu einem Indikator geben, kann ein sichtbarer Farbwechsel auftreten, der anzeigt, dass eine chemische Veränderung stattgefunden hat. Ein anderes Beispiel ist das Rosten von Eisen, bei dem die Farbe des Metalls von silbrig-grau zu rötlich-braun wechselt, was auf eine Oxidation hinweist.
Eine weitere deutliche Erscheinung während einer chemischen Reaktion ist die Entwicklung von Gas. Diese kann in Form von Blasen oder sogar als sichtbare Dampfentwicklung wahrgenommen werden. Ein klassisches Beispiel hierfür ist die Reaktion zwischen Essig und Backpulver, bei der Kohlendioxidgas freigesetzt wird. Das Aufschäumen dieses Gemischs zeigt deutlich die Bildung eines neuen Produktes.
Oft gehen diese Veränderungen mit anderen Phänomenen wie Temperaturänderungen oder Freisetzung von Licht einher. In diesem Zusammenhang spricht man von exothermen und endothermen Reaktionen.
Durch das Beobachten solcher Anzeichen können Chemiker besser verstehen, welche Prozesse ablaufen und wie die Moleküle sich verändern. Diese Zeichen helfen dabei, detaillierte Schlussfolgerungen über die beteiligten Reaktanten und die entstehenden Produkte zu ziehen.