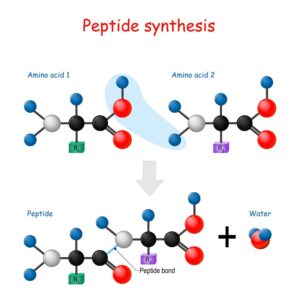
Was ist eine Substitution in der Chemie?
Die Substitutionsreaktion ist eine der fundamentalsten chemischen Reaktionen in der organischen Chemie. Bei dieser Reaktion wird ein Atom oder eine Atomgruppe im Molekül durch ein anderes Atom oder eine andere Atomgruppe ersetzt. Solche Reaktionen sind von großer Bedeutung für die Synthese verschiedener Verbindungen, da sie die Modifikation von Molekülen ermöglichen.
Es gibt zwei Hauptmechanismen für die Substitutionsreaktion: SN1 (monomolekulare nukleophile Substitution) und SN2 (bimolekulare nukleophile Substitution). Diese Mechanismen unterscheiden sich in ihrer Kinetik und im Verlauf der Reaktionspfade. Der SN1-Mechanismus erfolgt über das Zwischenprodukt eines Carbokations, während der SN2-Mechanismus einen Übergangszustand direkt aus den Ausgangsstoffen bildet.
Ein nukleophil greift das Elektrophil an und verdrängt dabei eine Abgangsgruppe; diese Dynamik macht die Substitutionsreaktion besonders relevant bei Halogenalkanen. Dabei spielen die Reaktionsbedingungen, wie Temperatur und Lösungsmittel, eine entscheidende Rolle. Zum Beispiel kann eine Säurekatalyse die Geschwindigkeit bestimmter Substitutionsreaktionen erheblich erhöhen.
Dieses Konzept wird oft im Rahmen des Chemieunterrichts untersucht, um das Verständnis für die Reaktionskinetik und molekulare Interaktionen zu vertiefen. Ein klares Verständnis dieser Reaktionen ist nicht nur für theoretische Fragestellungen, sondern auch für praktische Anwendungen, wie die Alkylierung in der Industrie, unverzichtbar.
Das Wichtigste in Kürze
- Substitutionsreaktionen ersetzen ein Atom oder eine Gruppe im Molekül durch ein anderes.
- SN1 und SN2 sind die Hauptmechanismen, unterschieden durch Kinetik und Reaktionsverlauf.
- SN1 verläuft über ein Carbokation, SN2 direkt durch einen Übergangszustand.
- Temperatur und Lösungsmittelwahl beeinflussen den Reaktionsmechanismus erheblich.
- Abgangsgruppen und Katalysatoren spielen zentrale Rollen bei der Effizienz der Reaktionen.
Eine Substitutionsreaktion ist eine chemische Reaktion, bei der ein Atom oder eine funktionelle Gruppe in einem Molekül durch ein anderes Atom oder eine andere funktionelle Gruppe ersetzt wird. Dies kann in organischen oder anorganischen Verbindungen auftreten und wird oft durch Reaktionsbedingungen wie Temperatur, Lösungsmittel und Katalysatoren beeinflusst.
Arten
- Elektrophile Substitution: Austausch eines elektrophilen Teilschen in einem Molekül gegen ein anderes Atom oder eine funktionelle Gruppe.
- Nucleophile Substitution: Austausch eines Atoms oder einer Gruppe in einem Molekül durch ein Nucleophil, das ein Elektronenpaar zur Verfügung stellt.
- Aromatische Substitution: Austausch einer funktionellen Gruppe in einem aromatischen Ring durch eine andere Gruppe, wobei die Ringstabilität erhalten bleibt.
- Radikale Substitution: Austausch eines Atoms oder einer Gruppe in einem Molekül unter Beteiligung von Radikalen, die ein ungepaartes Elektron besitzen.
- Aliphatische Substitution, bei der ein Atom oder eine funktionelle Gruppe in einem aliphatischen Molekül durch ein anderes Atom oder eine andere Gruppe ersetzt wird. Diese Art der Substitution tritt häufig bei Alkanen, Alkenen und Alkoholen auf.
- Sulfonierung, bei der eine Sulfongruppe in ein Molekül eingefügt wird. Dies kann beispielsweise durch die Reaktion mit Sulfiten oder Sulfonsäuren erfolgen und ist insbesondere in der organischen Synthese von Bedeutung.
- Halogenierung, bei der ein Halogenatom in ein Molekül eingefügt wird. Dies kann sowohl durch elektrophile als auch durch radikalische Mechanismen erfolgen und wird oft zur Modifizierung organischer Verbindungen verwendet.
- Addition, bei der zwei Moleküle miteinander reagieren und eine neue Verbindung bildet, ohne dass ein Atom oder eine Gruppe im Ausgangsmolekül ersetzt wird. Dieser Prozess führt zur Addition neuer Atome oder Gruppen an die vorhandenen Moleküle.
- Eliminierung, bei der aus einem Molekül ein Atom oder eine Gruppe entfernt wird, um eine Doppelbindung oder eine andere funktionelle Gruppe zu bilden. Dieser Prozess ist das Gegenteil der Addition und führt zur Entfernung von Atomen oder Gruppen aus dem Ausgangsmolekül.
Es gibt viele verschiedene Arten von Substitutionen in der Chemie, darunter Elektrophile Substitution, Nucleophile Substitution, Aromatische Substitution, Radikale Substitution, Aliphatische Substitution, Sulfonierung, Halogenierung, Addition und Eliminierung. Jede dieser Reaktionen hat spezifische Mechanismen und Anwendungen in der organischen Chemie.
Elektrophile Substitution
Elektrophile Substitution ist ein wichtiger Reaktionstyp in der organischen Chemie, bei dem ein elektrophiles Teilchen in einem Molekül gegen ein anderes Atom oder eine funktionelle Gruppe ausgetauscht wird. Dieser Reaktionstyp tritt häufig bei aromatischen Verbindungen auf, bei denen ein elektrophiles Reagenz an den aromatischen Ring addiert wird. Ein bekanntes Beispiel für eine elektrophile aromatische Substitution ist die Reaktion von Benzol mit Brom, wobei Brom an den Benzolring addiert wird und Wasserstoff abgespalten wird. Elektrophile Substitutionen sind für die Funktionalisierung von organischen Verbindungen von großer Bedeutung und ermöglichen die gezielte Einführung von verschiedenen funktionellen Gruppen in organische Moleküle. Es ist wichtig, die spezifischen Reaktionsmechanismen und Bedingungen für elektrophile Substitutionen zu verstehen, um sie effektiv in der organischen Synthese einzusetzen.
Nucleophile Substitution
Nucleophile Substitution ist ein fundamentaler Reaktionstyp in der organischen Chemie, bei dem ein Nucleophil an ein Elektrophil angreift und eine neue Bindung bildet. Dieser Reaktionstyp ist häufig bei Alkylhalogeniden zu beobachten, wo das Nucleophil das Halogenatom ersetzt. Ein typisches Beispiel für eine nucleophile Substitution ist die Reaktion von Natriumhydroxid mit Bromethan, bei der das Hydroxidion das Bromatom ersetzt und Ethanol gebildet wird. Nucleophile Substitutionen sind von großer Bedeutung für die Synthese und Modifikation organischer Verbindungen, da sie die Möglichkeit bieten, gezielt funktionelle Gruppen in Moleküle einzuführen oder auszutauschen. Die Kenntnis der Reaktionsmechanismen und Bedingungen für nucleophile Substitutionen ist entscheidend, um diese Reaktionen effizient in der organischen Synthese anzuwenden.
Aromatische Substitution
Bei der aromatischen Substitution handelt es sich um eine chemische Reaktion, bei der ein Wasserstoffatom in einem aromatischen Ring durch ein anderes Atom oder eine andere funktionelle Gruppe ersetzt wird. Dieser Prozess kann sowohl in der organischen Chemie als auch in der Biochemie auftreten und ist für die Synthese vieler organischer Verbindungen von großer Bedeutung.
Es gibt verschiedene Arten von aromatischen Substitutionen, darunter die elektrophile aromatische Substitution (EAS) und die nucleophile aromatische Substitution (SNS). Bei der EAS wird das Wasserstoffatom durch ein elektrophiles Teilchen ersetzt, während bei der SNS ein nucleophiles Teilchen den Austausch durchführt.
Ein bekanntes Beispiel für eine aromatische Substitution ist die Nitrierung von Benzol. Hier wird ein Wasserstoffatom des Benzolrings durch eine Nitrogruppe ersetzt, wodurch Nitrobenzol entsteht. Diese Reaktion ist ein wichtiger Schritt in der Synthese von Farbstoffen, Kunststoffen und anderen organischen Verbindungen.
Die aromatische Substitution ist ein vielseitiges chemisches Verfahren, das in vielen Bereichen der Chemie Anwendung findet. Durch das gezielte Ersetzen von Wasserstoffatomen können neue Verbindungen mit unterschiedlichen Eigenschaften und Anwendungen hergestellt werden.
Radikale Substitution
Die radikale Substitution ist ein wichtiger Reaktionstyp in der organischen Chemie, bei dem ein Wasserstoffatom in einer organischen Verbindung durch ein Radikal ersetzt wird. Radikale sind hochreaktive Moleküle mit einem ungepaarten Elektron, das dazu neigt, sich mit anderen Molekülen zu verbinden.
Im Gegensatz zur elektrophilen oder nucleophilen Substitution benötigt die radikale Substitution keine elektrophilen oder nucleophilen Reagenzien. Stattdessen beginnt die Reaktion mit der Bildung eines Radikals, meist durch Homolyse einer Bindung. Dieses Radikal reagiert dann mit der organischen Verbindung und ersetzt ein Wasserstoffatom.
Ein bekanntes Beispiel für eine radikale Substitution ist die Chlorierung von Methan. Bei dieser Reaktion reagiert Methan mit Chlorradikalen, wodurch ein Wasserstoffatom durch ein Chloratom ersetzt wird. Dieser Prozess wird in der Kunststoffherstellung und in der organischen Synthese häufig eingesetzt.
Die radikale Substitution ist aufgrund ihrer Spezifität und Reaktivität ein wichtiges Werkzeug in der organischen Chemie. Durch die gezielte Einführung von Radikalen können komplexe Moleküle hergestellt werden, die sonst schwer zugänglich wären.
Aliphatische Substitution
Die aliphatische Substitution ist eine wichtige Reaktion in der organischen Chemie, bei der ein Atom oder eine funktionelle Gruppe in einem aliphatischen Molekül durch ein anderes Atom oder eine andere Gruppe ersetzt wird. Aliphatische Verbindungen sind Kohlenwasserstoffe, die keine aromatischen Ringe enthalten und daher eine lineare oder verzweigte Struktur aufweisen.
Diese Art der Substitution tritt häufig bei Alkanen, Alkenen und Alkoholen auf und kann durch verschiedene Mechanismen erfolgen. Ein bekanntes Beispiel ist die Halogenierung von Alkanen, bei der ein Wasserstoffatom durch ein Halogenatom ersetzt wird. Dieser Prozess kann durch radikalische Substitution mit Halogenradikalen oder durch elektrophile Substitution mit Halogenkationen erfolgen.
Eine weitere wichtige Form der aliphatischen Substitution ist die Sulfonierung, bei der eine Sulfongruppe in ein Molekül eingefügt wird. Dies geschieht typischerweise durch Reaktion mit Sulfiten oder Sulfonsäuren und ist ein bedeutsamer Schritt in der organischen Synthese.
Die aliphatische Substitution spielt eine entscheidende Rolle in der Modifizierung organischer Verbindungen und der Herstellung komplexer Moleküle. Durch gezielte Substitution können neue funktionelle Gruppen eingeführt werden, um die Eigenschaften und Anwendungen von organischen Verbindungen zu verändern.
Sulfonierung als Substitution
Die Sulfonierung ist eine Art der Substitution in der organischen Chemie. Bei der Sulfonierung wird eine Sulfongruppe in ein Molekül eingefügt, wobei ein vorhandenes Atom oder eine funktionelle Gruppe im Molekül durch die Sulfongruppe ersetzt wird. Dieser Prozess kann als eine spezielle Form der Substitution betrachtet werden, bei der die Sulfongruppe die ersetzende Gruppe darstellt.
Halogenierung
Bei der Halogenierung wird ein Halogenatom in ein Molekül eingefügt, wobei ein vorhandenes Atom oder eine funktionelle Gruppe im Molekül durch das Halogenatom ersetzt wird. Dieser Prozess kann entweder durch einen radikalischen Mechanismus oder durch einen elektrophilen Mechanismus erfolgen, wodurch die Halogenierung als eine spezielle Art der Substitution betrachtet werden kann.
Addition
In der Chemie kann die Addition manchmal als Substitution betrachtet werden, insbesondere wenn bei der Addition neue Atome oder Gruppen hinzugefügt werden, die gleichzeitig ein bereits vorhandenes Atom oder eine vorhandene funktionelle Gruppe im Molekül ersetzen. Dieser spezielle Fall tritt auf, wenn die neu hinzugefügten Atome oder Gruppen anstelle von vorhandenen Atomen oder Gruppen in das Molekül eingebaut werden.
Bestimmte Reaktionen können sowohl als Addition als auch als Substitution betrachtet werden, abhängig vom Kontext und den beteiligten Molekülen. Bei einer Addition werden neue Atome oder Gruppen an ein Molekül hinzugefügt, während bei einer Substitution ein Atom oder eine Gruppe im Molekül durch eine andere ersetzt wird.
In einigen Fällen kann eine Addition als Substitution betrachtet werden, wenn die neu hinzugefügten Atome oder Gruppen ein bereits vorhandenes Atom oder eine bereits vorhandene Gruppe im Molekül ersetzen. Dies kann dazu führen, dass die Addition gleichzeitig als Substitution wahrgenommen wird, da sowohl eine Hinzufügung als auch ein Austausch von Atomen oder Gruppen stattfindet.
Es ist wichtig zu beachten, dass die Begriffe „Addition“ und „Substitution“ in der Chemie allgemeine Kategorien von Reaktionen sind und dass die genaue Klassifizierung einer Reaktion von den spezifischen Bedingungen und den beteiligten Molekülen abhängt. In einigen Fällen können Reaktionen Merkmale beider Kategorien aufweisen und entsprechend interpretiert werden.
Eine solche Reaktion kann als eine Art von Substitution angesehen werden, da ein Teil des Moleküls durch die neu hinzugefügten Atome oder Gruppen ersetzt wird. Gleichzeitig wird jedoch auch eine Addition beobachtet, da neue chemische Bindungen gebildet werden und die Gesamtstruktur des Moleküls verändert wird.
Dieses Konzept verdeutlicht, wie die Unterscheidung zwischen Addition und Substitution manchmal verschwimmen kann und wie eine Reaktion je nach Perspektive und Interpretation sowohl als Addition als auch als Substitution betrachtet werden kann. Es zeigt auch die Vielseitigkeit und Komplexität chemischer Reaktionen sowie die Notwendigkeit einer detaillierten Analyse der beteiligten Moleküle und Mechanismen, um ihre genaue Klassifizierung zu bestimmen.
Eliminierung
In der Chemie kann die Eliminierung manchmal als eine Form der Substitution betrachtet werden, insbesondere wenn bei der Eliminierung ein Atom oder eine Gruppe aus einem Molekül entfernt wird, um eine neue funktionelle Gruppe zu bilden. Dieser Prozess kann als Substitution angesehen werden, da ein Teil des Moleküls durch die neu entstandene funktionelle Gruppe ersetzt wird.
Bei der Eliminierung wird im Wesentlichen ein Atom oder eine Gruppe „ausgetauscht“ gegen eine andere funktionelle Gruppe, die durch die Entfernung entsteht. Obwohl die klassische Definition einer Substitution den Austausch eines vorhandenen Atoms oder einer vorhandenen Gruppe gegen eine andere beinhaltet, kann die Eliminierung aufgrund des Austauschs von Bindungen ebenfalls als eine Art der Substitution betrachtet werden.
Durch die Betrachtung der Eliminierung als Substitution wird deutlich, wie verschiedene Arten von Reaktionen in der organischen Chemie miteinander verknüpft sein können und wie die Grenzen zwischen den Reaktionstypen manchmal verschwimmen können. Dies unterstreicht die Komplexität chemischer Prozesse und die Bedeutung einer detaillierten Untersuchung der beteiligten Moleküle und Mechanismen, um ihre genaue Natur zu verstehen und zu klassifizieren.
Grundlagen der Substitutionsreaktion
Die Substitutionsreaktion ist eine der grundlegenden Reaktionen in der organischen Chemie. Bei dieser chemischen Reaktion wird ein Atom oder eine Atomgruppe in einem Molekül durch ein anderes Atom oder eine andere Atomgruppe ersetzt.
Ein nukleophil, also ein negativ geladener oder partiell negativer Teilchen, greift dabei ein Elektrophil an. Das Elektrophil ist hierbei oft ein positiv geladenes oder elektrophiles Zentrum im Molekül. Im Endeffekt führt die Substitution zur Stoffumwandlung und es entstehen neue Verbindungen, die als Reaktionsprodukte bezeichnet werden können.
Die Klassifizierung der Substitutionsreaktionen erfolgt hauptsächlich entsprechend der Art des angreifenden Nukleophils und des Mechanismus der Reaktion. So gibt es nucleophile Substitutionen (SN) und elektrophile Substitutionen (SE). Beispielsweise zählen Halogenalkane zu den typischen Substraten für nucleophile Substitution.
Zwischenprodukte spielen ebenfalls eine wichtige Rolle bei diesen Reaktionen. Ein bekanntes Zwischenprodukt ist das Carbokation, das vor allem bei SN1-Reaktionen auftritt. Diese Reaktionsbedingungen sind besonders stark lösungsmittelabhängig und temperaturempfindlich, was erheblichen Einfluss auf den Verlauf der Reaktion hat.
Substituenten am Molekül beeinflussen ebenso die Molekülstruktur und somit den gesamten Reaktionspfad. Die Kenntnis über diese Aspekte ist deshalb unerlässlich für den Chemieunterricht und die Anwendung der Substitutionsreaktionen in der Synthese neuer Verbindungen. Die korrekte Auswahl der Reaktionsbedingungen und der understanding of the Reaktionsmechanismen sind Schlüssel zum Erfolg in der organischen Synthese.
„Die Wissenschaft der Chemie beruht auf der Fähigkeit, bestehende Verbindungen zu brechen und neue aufzubauen durch die Kunst der Kombination und Substitution.“ – August Kekulé
| Mechanismus | Merkmale |
|---|---|
| SN1 |
|
| SN2 |
|
Substitutionsreaktion – Beispiele
Beispiele für eine Substitutionsreaktion in der organischen Chemie sind:
CH₄ + Cl₂ → CH₃Cl + HCl
Bei der Reaktion von Methan (CH₄) mit Chlor (Cl₂) entsteht Chloromethan (CH₃Cl) und Wasserstoffchlorid (HCl) als Produkte.
NaCl + AgNO₃ → AgCl + NaNO₃
Die Reaktion zwischen Natriumchlorid (NaCl) und Silbernitrat (AgNO₃) führt zur Bildung von Silberchlorid (AgCl) und Natriumnitrat (NaNO₃).
C₂H₆ + Br₂ → CH₃Br + HBr
Wenn Ethan (C₂H₆) mit Brom (Br₂) reagiert, bildet sich Bromethan (CH₃Br) und Wasserstoffbromid (HBr).
FeSO₄ + 2NaOH → Fe(OH)₂ + Na₂SO₄
Durch die Reaktion von Eisen(II)-sulfat (FeSO₄) mit Natriumhydroxid (NaOH) entstehen Eisen(II)-hydroxid (Fe(OH)₂) und Natriumsulfat (Na₂SO₄).
Mechanismen: SN1 und SN2
Bei den Substitutionsreaktionen in der organischen Chemie gibt es zwei Hauptmechanismen: SN1 und SN2. Diese Mechanismen unterscheiden sich erheblich im Reaktionsverlauf und bei den beteiligten Molekülen.
Der SN1-Mechanismus (Substitution Nucleophil, unimolecular) verläuft über ein zweistufiges Verfahren. Zunächst bildet sich ein Carbokation, nachdem die Abgangsgruppe das Substrat verlassen hat. Dieses Zwischenprodukt ist besonders stabil, wenn das Carbokation durch umgebende Alkylgruppen stabilisiert werden kann. Typische Stoffe für diesen Mechanismus sind Halogenalkane mit tertiären Kohlenstoffatomen. Die Bildung des Carbokations hängt stark von den Reaktionsbedingungen ab, wie etwa der Säurekatalyse oder dem verwendeten Lösungsmittel.
Im Gegensatz dazu erfolgt der SN2-Mechanismus (Substitution Nucleophil, bimolecular) in nur einem Schritt. Hier greift das Nukleophil gleichzeitig an, während die Abgangsgruppe das Substrat verlässt. Dies führt zu einer Umkehr der Molekülstruktur am Reaktionszentrum, was als Walden-Umkehr bekannt ist. SN2-Reaktionen treten bevorzugt bei primären Halogenalkanen auf, da hier der sterische Hinderungsfaktor minimal ist.
Die Wahl des Mechanismus hängt somit eng von der Struktur des Substrats, der Stabilität des möglichen Zwischenprodukts und den spezifischen Reaktionsbedingungen ab. Das Verstehen dieser Mechanismen und der damit verbundenen chemischen Reaktion ermöglicht es chemikern, gezielt bestimmte Reaktionsprodukte zu erzeugen und eine effiziente Synthese durchzuführen.
Einfluss der Reaktionsbedingungen
Bei Substitutionsreaktionen spielen verschiedene Faktoren eine Rolle, wie beispielsweise die Art der funktionellen Gruppen, die Reaktivität der Reaktionspartner und die Reaktionsbedingungen. Substitutionsreaktionen sind ein wichtiger Teil der organischen Chemie und werden häufig in der Synthese von organischen Verbindungen verwendet. Es ist wichtig, die Mechanismen und Bedingungen der jeweiligen Art von Substitutionsreaktion zu verstehen, um gezielt gewünschte Produkte herstellen zu können.
Der Einfluss der Reaktionsbedingungen auf eine Substitutionsreaktion ist erheblich und kann das Ergebnis und die Geschwindigkeit der chemischen Reaktion tiefgreifend beeinflussen. Eine der wichtigsten Bedingungen, die berücksichtigt werden müssen, ist die Temperatur. Bei höheren Temperaturen tendieren die Moleküle dazu, sich schneller zu bewegen, was die Wahrscheinlichkeit von Zusammenstößen zwischen den Reaktanten erhöht. Dies begünstigt insbesondere den SN2-Mechanismus, da hierbei ein direkter Angriff des nukleophilen Teilchens auf das Elektrophil erfolgt.
Ein weiterer entscheidender Faktor ist das Lösungsmittel. Polare, protische Lösungsmittel wie Wasser oder Alkohol fördern den SN1-Mechanismus, da sie die Bildung eines Carbokations stabilisieren können. Im Gegensatz dazu bevorzugen polare, aprotische Lösungsmittel wie Acetonitril oder DMSO den SN2-Mechanismus, indem sie das nukleophile Teilchen besser solvatisieren und somit reaktiver machen.
Die Konzentration der Reaktanten spielt ebenfalls eine Rolle. Hohe Konzentrationen des Nukleophils fördern typischerweise SN2-Reaktionen, während geringere Konzentrationen oft zu SN1-Reaktionen führen können.
Säurekatalyse kann den Reaktionsablauf zusätzlich erleichtern, besonders wenn es um die Protonierung einer ineffizienten Abgangsgruppe geht. Die Wahl der Base ist auch wichtig für die Reaktionsgeschwindigkeit und -richtung. In vielen Fällen wird bei der Säurekatalyse eine Stoffumwandlung erreicht, die dem Sn1 oder Sn2 Reaktionsmechanismus entspricht.
Rolle der Abgangsgruppe
In der organischen Chemie spielt die Abgangsgruppe eine zentrale Rolle bei Substitutionsreaktionen. Die Abgangsgruppe ist das Atom oder die Molekülgruppe, die während der chemischen Reaktion vom Rest des Moleküls abgetrennt wird. Ihre Fähigkeit, sich zu lösen und stabil zu bleiben, beeinflusst maßgeblich den Verlauf der Reaktion.
Zum Beispiel ist in einer SN1-Reaktion („Substitution Nucleophilic Unimolecular“) die Qualität der Abgangsgruppe entscheidend für die Bildung eines Carbokations, welches als Zwischenprodukt auftritt. Dieses Zwischenprodukt erleichtert den Angriff des Nukleophils. Daher sind gute Abgangsgruppen typischerweise schwache Basen wie Halogenide (z.B. Chlorid, Bromid) oder Sulfonate. In dieser Art von Reaktionen kann die Stabilität des Carbokations durch die Wahl der Abgangsgruppe verbessert werden.
Dagegen spielt bei einer SN2-Reaktion („Substitution Nucleophilic Bimolecular“) der direkte Angriff des Nukleophils auf das Kohlenstoffatom und die gleichzeitige Abspaltung der Abgangsgruppe eine wichtige Rolle. Hier ist die Molekülstruktur bedeutend, da sterische Hinderung den Zugang des Nukleophils erschweren kann. Eine geeignete Abgangsgruppe kann jedoch die Energiebarriere dieses Mechanismus senken.
Beachte auch, dass die Säurekatalyse die Effizienz der Abgangsgruppen verbessern kann. Säuren können Protonen spenden, was die Anfälligkeit der Bindung zwischen dem Molekülrest und der Abgangsgruppe erhöht. Dies ermöglicht eine schnellere und effektivere Stoffumwandlung im Rahmen der Synthese chemischer Verbindungen.
Durch das Verständnis des Einflusses der Abgangsgruppen können Chemiker gezielt Reaktionsprodukte steuern und optimieren. Insgesamt ist das Wissen über die Rolle der Abgangsgruppe wesentlich für die Planung von chemischen Reaktionen und die Entwicklung neuer Synthesen in der organischen Chemie.
Anwendung in der organischen Synthese
Eine der bedeutendsten Anwendungen von Substitutionsreaktionen findet sich in der organischen Synthese. Diese chemischen Reaktionen werden häufig verwendet, um komplexe Moleküle aus einfacheren Vorläufern herzustellen. In der organischen Chemie sind Halogenalkane oft Ausgangspunkte in Substitutionsreaktionen, da das Halogen eine gute Abgangsgruppe darstellt und durch andere Gruppen ersetzt werden kann.
Ein klassisches Beispiel für die Anwendung in der Synthese ist die Herstellung von Alkoholen aus Halogenalkanen. Hierbei wird ein Halogenatom durch eine Hydroxylgruppe ersetzt, wobei die Reaktion üblicherweise unter basischen Bedingungen abläuft. Dies ermöglicht den Aufbau von Alkoholgruppen in Molekülen, was wiederum die Grundlage für viele weiterführende chemische Reaktionen bildet, wie etwa die Alkylierung oder Oxidationsreaktionen.
Durch gezielte Substitution lassen sich spezifische funktionelle Gruppen in einem Molekül einführen oder modifizieren. Diese Fähigkeit macht die Substitutionsreaktion zu einem unverzichtbaren Werkzeug bei der Synthese von Arzneimitteln, Kunststoffen und anderen wichtigen chemischen Verbindungen.
In der Praxis können solche Reaktionen durch verschiedene Reaktionsbedingungen wie Temperatur und Lösungsmittelwahl kontrolliert werden. Die Einstellbarkeit der Reaktionsbedingungen bietet Chemikern die Möglichkeit, präzise und effizient gewünschte Reaktionsprodukte zu erhalten.
Zusätzlich ermöglichen Substitutionsreaktionen die Erzeugung von Zwischenprodukten, welche dann in weiteren Schritten des Syntheseweges genutzt werden können. Dieser Aspekt beleuchtet die Vielseitigkeit dieser Reaktionen, besonders in der Forschung und Entwicklung neuer Verbindungen.
| Mechanismus | Reaktionsschritte | Beispiele |
|---|---|---|
| SN1 |
|
|
| SN2 |
|
|
Vergleich mit anderen Reaktionstypen
Die Substitutionsreaktion unterscheidet sich von anderen Reaktionstypen, insbesondere der Additionsreaktion und Eliminationsreaktion, durch ihren spezifischen Mechanismus. Während bei der Additionsreaktion neue Atome oder Gruppen an eine Doppel- oder Dreifachbindung gebunden werden, kommt es bei der Eliminationsreaktion zur Abspaltung von Atomen oder Gruppen, wobei oft Mehrfachbindungen entstehen.
Ein markanter Unterschied ist, dass Substitutionsreaktionen in erster Linie bei gesättigten Molekülen wie Halogenalkanen ablaufen. Hierbei wird ein Atom oder eine Gruppe gegen ein anderes ausgetauscht, während die Grundstruktur des Moleküls erhalten bleibt.
Bei einer Additionsreaktion hingegen ändert sich die Molekülstruktur wesentlich mehr; beispielsweise wird aus einem Alken ein Alkan, indem die Doppelbindung aufgelöst wird.
Im Gegensatz dazu führt die Eliminationsreaktion zur Bildung ungesättigter Verbindungen. Betrachten wir etwa eine Alkylierung, so handelt es sich häufig um eine Substitution, während klassische Additionen bei Alkenen stattfinden.
Ein weiterer Unterscheidungspunkt liegt im Einsatz von Katalysatoren. Substitutionsreaktionen laufen oft unter speziellen Bedingungen wie etwa Säurekatalyse ab, während bei Additionsreaktionen metallische Katalysatoren häufiger zum Einsatz kommen.
Kurz gesagt: Substitutionsreaktionen betonen den Austausch von Substituenten, Additionen verändern Bindungen signifikant und Eliminationen führen zu ungesättigten Produkten. Jeder dieser Mechanismen bietet somit einzigartige Reaktionspfade für die komplexe Welt der organischen Chemie.
Temperatur- und Lösungsmittelabhängigkeit
Die Substitutionsreaktion zeigt eine bemerkenswerte Abhängigkeit von der Temperatur und dem verwendeten Lösungsmittel. Grundsätzlich beeinflussen diese zwei Faktoren den Reaktionsmechanismus erheblich.
Bei der SN1-Reaktion spielt die Temperatur eine wesentliche Rolle, da sie die Bildung eines Carbokations fördert. Eine höhere Temperatur begünstigt oftmals das Zerfallen des Ausgangsprodukts in ein Zwischenprodukt, wodurch der Reaktionspfad beschleunigt wird. Im Vergleich dazu ist die SN2-Reaktion weniger temperaturempfindlich, jedoch kann eine moderate Erhöhung der Temperaturen die Energiebarriere verringern und so die Reaktionsgeschwindigkeit steigern.
Das Lösungsmittel bestimmt maßgeblich die Effizienz und Selektivität der Reaktion. Polare protische Lösungsmittel wie Wasser oder Methanol stabilisieren das Carbokation durch Säurekatalyse bei SN1-Reaktionen. Demgegenüber bevorzugen SN2-Reaktionen polare aprotische Lösungsmittel wie Acetonitril oder Dimethylsulfoxid (DMSO), weil diese nicht zur Bildung von Wasserstoffbrücken beitragen und damit das nukleophile Angriffsvermögen erhöhen.
Zum Beispiel führt die Durchführung einer Substitution mit Halogenalkanen in einem polaren aprotischen Medium zu höheren Ausbeuten an gewünschten Reaktionsprodukten. Hierdurch können gezielte Stoffumwandlungen und Synthesen unter optimalen Bedingungen vorgenommen werden.
Schlussendlich zeigen Experimente im Chemieunterricht eindrucksvoll, wie Temperatur- und Lösungsmittelabhängigkeiten direkt auf die Eigenschaften und Reaktivitäten verschiedener Substituenten und Elektrophile wirken.
In manchen Substitutionsreaktionen kann Dampf entstehen. Ein Beispiel dafür ist die Reaktion zwischen Salzsäure (HCl) und Eisen(II)-sulfid (FeS), bei der Wasserstoffgas (H₂) freigesetzt wird. Diese Reaktion führt zur Bildung von Eisen(II)-chlorid (FeCl₂) und Wasserstoffgas (H₂), wobei Wasserstoffgas als Gas oder Dampf freigesetzt wird.
Reaktionskinetik und -dynamik
Reaktionskinetik und -dynamik spielen eine zentrale Rolle bei Substitutionsreaktionen in der organischen Chemie. Diese Aspekte helfen uns, besser zu verstehen, warum bestimmte Reaktionen ablaufen und wie schnell sie das tun. Bei einer Substitution wechselt ein Substituent im Ausgangsmolekül mit einem anderen aus, was die Umstrukturierung von Molekülen ermöglicht.
Eine vereinfachte Vorstellung dieser Prozesse ergibt sich durch Betrachtung der Reaktionsgeschwindigkeit. Die SN1 (Substitution Nukleophil Unimolekular) und SN2 (Substitution Nukleophil Bimolekular) Mechanismen unterscheiden sich hier grundlegend. Bei SN1 erfolgt die Reaktion in zwei Schritten: Zuerst bildet sich ein Zwischenprodukt, das Carbokation, dann greift der nukleophile Teil das Molekül an. Die Geschwindigkeit hängt hierbei vom Zerfall des ursprünglichen Moleküls ab.
Im Gegensatz dazu verläuft die SN2-Reaktion in einem einzigen Schritt, bei dem der nukleophile und der abgehende Teil gleichzeitig am Angriffspunkt des Moleküls agieren. Daher ist die Geschwindigkeit von sowohl der Konzentration des Ausgangsstoffs als auch des Nukleophils abhängig. Die Wechselwirkungen in diesem Prozess können direkt beobachtet werden, um Einsichten in den genauen Reaktionspfad zu gewinnen.
Die Studie der Reaktionskinetik liefert somit wertvolle Informationen über die molekulare Struktur und die Bedingungen, unter denen verschiedene Stoffumwandlungen effizient durchgeführt werden können. Durch Anpassungen wie Lösungsmittelwahl oder Temperatur lässt sich Einfluss auf die Geschwindigkeit und Ausbeute der Reaktion nehmen, was die Synthese komplexer Verbindungen erleichtert.
Farbänderungen
Es gibt Substitutionsreaktionen, bei denen sich die Farbe ändert. Ein bekanntes Beispiel dafür ist die Reaktion zwischen Silbernitrat (AgNO₃) und Natriumchlorid (NaCl), bei der Silberchlorid (AgCl) gebildet wird. Die Ausgangsstoffe sind farblos, während das entstehende Silberchlorid eine charakteristische weiße Farbe aufweist. Diese Farbänderung ist ein deutlicher Hinweis auf die ablaufende Substitutionsreaktion.
Ein Beispiel für eine Substitutionsreaktion, bei der eine grüne Farbe entstehen kann, ist die Reaktion zwischen Kupfersulfat (CuSO₄) und Natriumhydroxid (NaOH). Bei dieser Reaktion bildet sich Kupferhydroxid (Cu(OH)₂), das eine charakteristische grüne Farbe aufweist. Die anfänglich farblose Kupfersulfat-Lösung wird durch die Bildung des grünen Kupferhydroxids sichtbar grün.