Was sind Säure-Base-Reaktionen?
Die Chemie der Säure-Base-Reaktionen spielt eine zentrale Rolle in unserem täglichen Leben und in vielen industriellen Prozessen. Diese Reaktionen sind entscheidend für das Verständnis von pH-Werten, die Bestimmung der Stärke von Säuren und Basen sowie deren Auswirkungen auf verschiedene Systeme.
Eine Säure-Base-Reaktion wird oft durch den Austausch von Protonen (H⁺-Ionen) zwischen Molekülen oder Ionen definiert. Säuren geben dabei Protonen ab, während Basen Protonen aufnehmen. Dieses Konzept wurde erstmals von Johannes Nicolaus Brønsted und Thomas Martin Lowry formuliert und revolutionierte unser Verständnis chemischer Reaktionen.
Neben diesen klassischen Definitionen gibt es noch andere Modelle zur Erklärung dieser Reaktionen, wie zum Beispiel das Konzept von Lewis-Säuren und -Basen. Durch das Studium von Säure-Base-Reaktionen können wir auch tiefer in verwandte Themen wie Redoxreaktionen eintauchen, die ebenfalls wichtige chemische Prozesse beschreiben.
Das Wichtigste in Kürze
- Säuren geben Protonen (H⁺) ab, Basen nehmen sie auf.
- Der pH-Wert misst die Wasserstoffionenkonzentration, Skala: 0-14.
- Pufferlösungen stabilisieren den pH-Wert, wichtig für biologische Systeme.
- Neutralisation: Säure + Base → Wasser + Salz.
- Säure-Base-Reaktionen sind essenziell in Industrie und Alltag.
Säure-Base-Reaktionen sind chemische Reaktionen, bei denen eine Säure und eine Base miteinander reagieren und Salze sowie Wasser bilden. Säuren sind Substanzen, die Protonen (H⁺-Ionen) abgeben können, während Basen Substanzen sind, die Protonen aufnehmen können. In einer Säure-Base-Reaktion neutralisiert die Base die Säure durch die Aufnahme von Protonen, wodurch ein Salz und Wasser entstehen. Säure-Base-Reaktionen sind ein fundamentales Konzept in der Chemie und haben weitreichende Anwendungen in verschiedenen Bereichen wie der Biochemie, der Umweltchemie und der Industrie.
Beispiele
- Reaktion von Salzsäure (HCl) mit Natriumhydroxid (NaOH): HCl + NaOH -> NaCl + H2O
- Neutralisation von Schwefelsäure (H2SO4) mit Kalilauge (KOH): H2SO4 + 2KOH -> K2SO4 + 2H2O
- Reaktion von Essigsäure (CH3COOH) mit Natriumbicarbonat (NaHCO3): CH3COOH + NaHCO3 -> CH3COONa + CO2 + H2O
- Neutralisation von Salpetersäure (HNO3) mit Calciumhydroxid (Ca(OH)2): 2HNO3 + Ca(OH)2 -> Ca(NO3)2 + 2H2O
- Reaktion von Schwefelsäure (H2SO4) mit Ammoniak (NH3): H2SO4 + 2NH3 -> (NH4)2SO4
- Neutralisation von Salzsäure (HCl) mit Natriumcarbonat (Na2CO3): 2HCl + Na2CO3 -> 2NaCl + CO2 + H2O
- Reaktion von Phosphorsäure (H3PO4) mit Kaliumhydroxid (KOH): 3H3PO4 + 6KOH -> 6H2O + 2K3PO4
- Neutralisation von Essigsäure (CH3COOH) mit Calciumcarbonat (CaCO3): 2CH3COOH + CaCO3 -> (CH3COO)2Ca + CO2 + H2O
- Reaktion von Schwefelsäure (H2SO4) mit Natriumsulfid (Na2S): H2SO4 + Na2S -> 2NaHS + SO2 + H2O
Definition Säure-Base-Reaktion
Eine Säure-Base-Reaktion beschreibt den Prozess, bei dem eine Säure ein oder mehrere Protonen (H+) an eine Base abgibt. Diese Reaktionen sind grundlegende chemische Prozesse und spielen in vielen Bereichen der Chemie eine zentrale Rolle.
Die Konzepte der Säuren und Basen wurden durch das Brønsted-Lowry-Modell weiterentwickelt. Das Symbol „ø“ wird im Brønsted-Lowry-Modell als Darstellung für ein Proton verwendet. Gemäß diesem Modell handelt es sich um ein Proton, das von einer Säure an eine Base übertragen wird. Der dänische Wissenschaftler Johannes Nicolaus Brønsted hat tatsächlich das „ø“ im Namen. Das Symbol „ø“ wird im Dänischen als spezieller Buchstabe verwendet und wird wie ein „ö“ ausgesprochen. Man würde ihn also in deutscher Schreibweise als Johannes Nicolaus Brönsted darstellen.
Im Kern geht es darum, dass Säuren als Protonendonatoren und Basen als Protonenakzeptoren wirken. Dieses Modell baut auf die Vorstellung auf, dass Säuren und Basen in Wasser dissoziieren und dabei Ionen freisetzen. Zum Beispiel dissoziiert Salzsäure in Wasser und gibt H+-Ionen ab, während Natriumhydroxid OH–-Ionen freisetzt, die H+ aufnehmen.
Das Verständnis solcher Reaktionen ist essentiell, da sie beispielsweise bei der Titration zur Bestimmung von Konzentrationen eingesetzt werden können. Eine weitere Anwendung besteht im Pufferbereich, wo schwache Säuren und ihre konjugierten Basen verwendet werden, um den pH-Wert stabil zu halten. Durch genaue Kontrolle dieser Reaktionen lassen sich optimale Bedingungen für verschiedene chemische Prozesse schaffen.
Säure-Base-Reaktionen sind eng mit den komplexeren Redoxreaktionen verbunden und tragen wesentlich zum Gleichgewicht in chemischen Systemen bei. Daher sind sie auch unentbehrlich für das Verständnis vieler biologischer und industrieller Vorgänge.
Die Chemie ist nicht nur die Formel der Moleküle, sondern das Spiel der Kräfte, das sie zusammenhält. – Robert H. Grubbs
| Begriff | Beschreibung |
|---|---|
| Säure | Ein Stoff, der Protonen (H+) abgibt. |
| Base | Ein Stoff, der Protonen (H+) aufnimmt. |
| pH-Wert | Ein Maß für den Säure- oder Basengehalt einer Lösung. |
| Pufferlösung | Eine Lösung, die den pH-Wert stabil hält. |
| Neutralisation | Reaktion zwischen einer Säure und einer Base, die zu Wasser und einem Salz führt. |
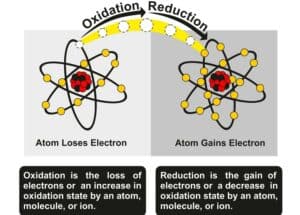
| Redoxreaktion | Ein chemischer Prozess, bei dem Elektronen zwischen Reaktanten übertragen werden. |
Brønsted-Lowry-Säuren und Basen
Die Theorie der Brønsted-Lowry-Säuren und Basen beschreibt Säuren als Protonendonatoren und Basen als Protonenakzeptoren. Diese Definition erweitert das Verständnis von Säure-Base-Reaktionen im Vergleich zu älteren Konzepten, da sie nicht auf wässrige Lösungen beschränkt ist.
Ein Schlüsselelement dieser Theorie ist die Konjugation von Säure-Basen-Paaren. Wenn eine Säure ein Proton (H+) abgibt, bildet sich eine konjugierte Base. Umgekehrt entsteht aus einer Base eine konjugierte Säure durch Aufnahme eines Protons. Dieses Konzept hilft dabei, zahlreiche chemische Reaktionen besser zu verstehen.
Beispielsweise wird beim Anlösen von Chlorwasserstoffgas in Wasser HCl in H3O+ (Oxonium-Ion) und Cl– (Chlorid-Ion) zerlegt. Hier fungiert HCl als Protonendonator und Wasser als Protonenakzeptor. In diesem Szenario ist Cl– die konjugierte Base von HCl und H3O+ die konjugierte Säure von Wasser.
Sowohl im Alltag wie auch bei industriellen Prozessen spielen Brønsted-Lowry-Säuren und Basen eine zentrale Rolle. Sie sind beispielsweise entscheidend in der Herstellung von Düngemitteln, Medikamenten und vielen anderen chemischen Substanzen. Es ist wichtig zu verstehen, dass diese Mechanismen eng mit anderen chemischen Reaktionen, wie z.B. Redoxreaktionen, vernetzt sind.
pH-Wert und seine Messung
Der pH-Wert ist ein Maß für die Konzentration von Wasserstoffionen in einer Lösung. Er gibt an, wie sauer oder basisch eine Flüssigkeit ist, und reicht von 0 bis 14. Ein pH-Wert unter 7 bedeutet, dass die Lösung sauer ist, während ein Wert über 7 auf eine basische Lösung hinweist. Ein pH-Wert von 7 gilt als neutral.
Die Messung des pH-Werts kann auf verschiedene Weisen erfolgen. Eine gängige Methode ist der Einsatz von Indikatorlösungen oder -papieren, die ihre Farbe je nach pH-Wert der untersuchten Flüssigkeit ändern. Diese Methode ist schnell und einfach, liefert jedoch nur grobe Schätzungen.
Für präzisere Messungen wird ein elektrisches Gerät namens pH-Meter verwendet. Ein pH-Meter besteht aus einer speziellen Elektrode, die direkt in die Lösung getaucht wird. Die Elektrode misst die Spannung, die durch den unterschiedlichen pH-Wert erzeugt wird, und zeigt diesen dann digital an.
In wissenschaftlichen und industriellen Prozessen ist die genaue Bestimmung des pH-Werts äußerst wichtig. So entscheidet der pH-Wert oft darüber, ob bestimmte chemische Reaktionen, wie beispielsweise Redoxreaktionen, ablaufen können oder nicht. Daher finden sich pH-Messgeräte häufig in Laboren und Produktionsanlagen.
Darüber hinaus spielt der pH-Wert eine wichtige Rolle in vielen Bereichen des Alltags. Zum Beispiel wird der pH-Wert von Trinkwasser regelmäßig überwacht, um sicherzustellen, dass es innerhalb eines sicheren Bereichs liegt. Auch bei der Herstellung bestimmter Lebensmittel und Getränke, wie etwa Käse oder Wein, kommt es auf den richtigen pH-Wert an.
Bedeutung der Pufferlösungen
Pufferlösungen spielen eine zentrale Rolle bei der Stabilisierung des pH-Wertes von Lösungen. Sie bestehen in der Regel aus einer schwachen Säure und ihrer konjugierten Base oder umgekehrt. Ein wichtiger Aspekt dieser Kombination ist, dass Pufferlösungen die Fähigkeit besitzen, Änderungen des pH-Wertes zu widerstehen, selbst wenn kleine Mengen starker Säuren oder Basen hinzugefügt werden.
Dies ist besonders relevant in biologischen Systemen, wo enge pH-Bereiche für das Funktionieren biochemischer Prozesse notwendig sind. Beispielsweise bleibt der Blutzuckerspiegel beim Menschen dank spezieller Puffermechanismen weitgehend konstant. In vielen enzymatischen Reaktionen ist ein spezifischer pH-Wert von größter Bedeutung für die Aktivität und Stabilität der Enzyme.
Auch in industriellen Prozessen finden Pufferlösungen Verwendung. Bei der Herstellung von Medikamenten, Lebensmitteln oder im Chemielaboratorium sorgen sie dafür, dass die Bedingungen während einer chemischen Reaktion stabil bleiben.
Durch die Nachhaltigkeit, Flexibilität und Zuverlässigkeit, die Pufferlösungen bieten, wird es möglich, komplexe Vorgänge sicher und kontrolliert abzuwickeln.
Neutralisationsreaktionen im Alltag
Neutralisationsreaktionen spielen eine wichtige Rolle im Alltag und finden sich in vielen Bereichen wieder. Ein klassisches Beispiel dafür ist die Verwendung von Backpulver, das meist Natriumhydrogencarbonat enthält. Beim Backen reagiert dieses mit sauren Zutaten wie Zitronensaft oder Essig. Die Neutralisation hat zwei Hauptfunktionen: Sie trägt zur Lockerung des Teigs bei und neutralisiert den Geschmack überschüssiger Säure.
Ein weiteres Beispiel einer Neutralisationsreaktion findet sich in der Medizin. Bei Sodbrennen wird häufig ein Antazidum verwendet, das Säure im Magen neutralisiert. Diese Medikamente enthalten Basen wie Magnesiumhydroxid oder Calciumcarbonat, die die überschüssige Magensäure binden und zu Wasser und anderen harmlosen Substanzen umwandeln. Dies lindert die unangenehmen Symptome und schützt die Magenwand vor weiteren Schäden.
Auch bei Reinigungsprozessen kommen Neutralisationsreaktionen zum Einsatz. Reiniger für Abflussrohre, die häufig alkalische Stoffe enthalten, reagieren mit säurehaltigen Rückständen und führen so zu ihrer Zersetzung. Dadurch können die Rohre wieder frei fließen und Verstopfungen werden beseitigt.
Zusätzlich spielen Neutralisationsreaktionen in verschiedenen industriellen Prozessen eine entscheidende Rolle. Bei der Abwasseraufbereitung etwa werden Säuren und Basen strikt kontrolliert, um einen neutralen pH-Wert des ausgeleiteten Wassers zu gewährleisten. Hierbei geht es nicht nur um den Umweltschutz, sondern auch darum, Korrosionsschäden an Rohrleitungen und Anlagen zu vermeiden.
Diese alltäglichen Beispiele zeigen, dass Neutralisationsreaktionen weit über den Chemieunterricht hinaus relevant sind und einige interessante Parallelen zu Redoxreaktionen aufweisen.
| Begriff | Beschreibung | Beispiel |
|---|---|---|
| Säure | Ein Stoff, der Protonen (H+) abgibt. | Salzsäure (HCl) |
| Base | Ein Stoff, der Protonen (H+) aufnimmt. | Natriumhydroxid (NaOH) |
| pH-Wert | Ein Maß für den Säure- oder Basengehalt einer Lösung. | pH 7 für Wasser |
| Pufferlösung | Eine Lösung, die den pH-Wert stabil hält. | Essigsäure/Acetat |
| Neutralisation | Reaktion zwischen einer Säure und einer Base, die zu Wasser und einem Salz führt. | HCl + NaOH → NaCl + H₂O |
| Redoxreaktion | Ein chemischer Prozess, bei dem Elektronen zwischen Reaktanten übertragen werden. | Zn + Cu²⁺ → Zn²⁺ + Cu |
Anwendung in chemischen Prozessen
Säure-Base-Reaktionen sind in vielen chemischen Prozessen von entscheidender Bedeutung. Eines der häufigsten Einsatzgebiete ist die chemische Synthese. Hier werden Säuren und Basen verwendet, um Reaktionen zu katalysieren oder als Reaktanten selbst beizutragen. Beispielsweise sind Carbonsäuren und Amine häufig verwendete Ausgangsstoffe in der organischen Chemie.
Ein weiteres wichtiges Anwendungsfeld ist die Wasseraufbereitung. Im Bereich der Abwasserbehandlung spielen Neutralisationsreaktionen eine zentrale Rolle. Dabei werden saure oder basische Abwässer auf einen neutralen pH-Wert gebracht, bevor sie weiterverarbeitet oder entsorgt werden. Dies schützt nicht nur die Umwelt, sondern auch die Infrastruktur vor Korrosion.
In der Lebensmittelindustrie werden Säure-Base-Reaktionen genutzt, um den Geschmack und die Haltbarkeit von Produkten zu beeinflussen. Ein Beispiel hierfür ist das Backpulver, das in Teigen verwendet wird, um Kohlendioxid freizusetzen und das Gebäck aufgehen zu lassen.
Auch in medizinischen Anwendungen finden solche Reaktionen ihren Platz. Arzneimittelhersteller nutzen die Prinzipien der Säure-Base-Chemie, um Medikamente mit optimaler Wirkung und Stabilität herzustellen. Viele Wirkstoffe müssen in einer bestimmten ionisierten oder nicht-ionisierten Form vorliegen, um ihre Funktion effektiv erfüllen zu können.
Schließlich dürfen wir die Rolle der Säure-Base-Chemie in der Erforschung neuer Materialien nicht vergessen. Hier ermöglichen es diese Reaktionen, spezifische Eigenschaften wie Leitfähigkeit oder mechanische Stabilität gezielt einzustellen.