Was ist Hydrolyse-Reaktion?
Die Hydrolyse-Reaktion spielt in der biochemischen und industriellen Welt eine entscheidende Rolle. Unter Hydrolyse versteht man die Zerlegung von Molekülen durch Wasser, wobei sich Wassermoleküle an chemische Bindungen anlagern und diese spalten. Diese Reaktionen sind nicht nur grundlegend für die Verdauung von Nahrung im menschlichen Körper, sondern finden auch Anwendung in pharmazeutischen und chemischen Produktionseinheiten.
Es gibt verschiedene Arten der Hydrolyse wie saure, basische und enzymatische Hydrolyse. Jede dieser Reaktionsformen hat ihren eigenen Mechanismus und Energiebedarf, abhängig von den jeweiligen Bedingungen. Besonders wichtig ist die Tatsache, dass viele dieser Verfahren mit minimalen Abfallprodukten und Nebenreaktionen einhergehen, was sie zu umweltfreundlichen Prozessen macht. Beispiele für Hydrolyse-Reaktionen umfassen die Spaltung von Estern, Amiden und Glykosiden, die häufig auch als Säure-Base-Reaktion vorkommen können.
Das Wichtigste in Kürze
- Hydrolyse: Prozess der Zerlegung von Molekülen durch Wasser
- Arten: Saure, basische und enzymatische Hydrolyse
- Anwendungen: Verdauung, pharmazeutische und chemische Produktion
- Energiebedarf: Abhängig von Katalysatoren und Reaktionsbedingungen
- Umweltfreundlich: Minimale Abfallprodukte und Nebenreaktionen
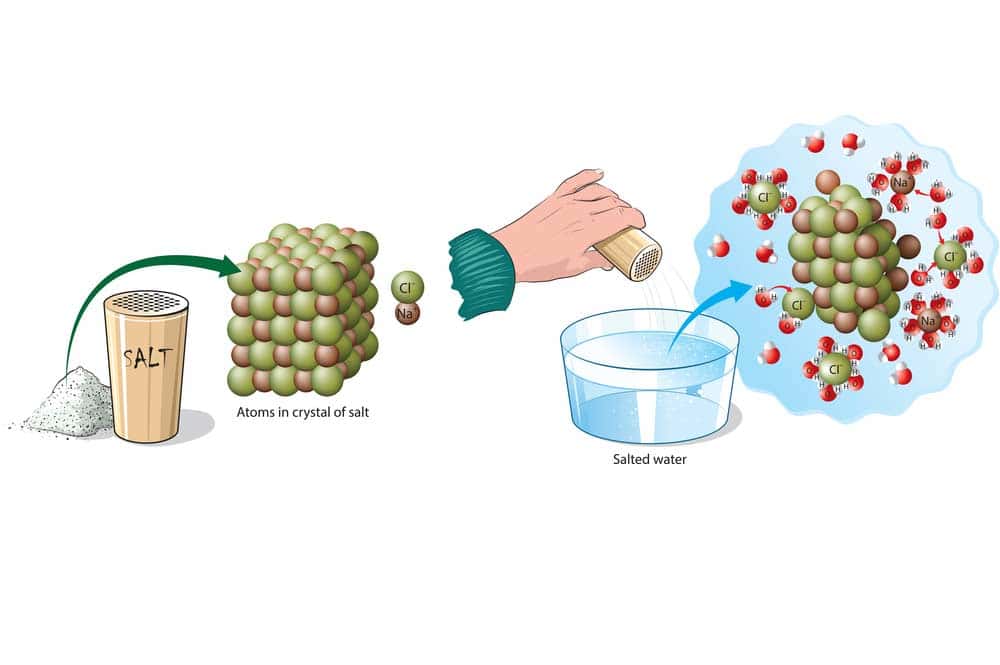
Bei einer Hydrolyse-Reaktion handelt es sich um eine chemische Reaktion, bei der eine chemische Verbindung durch Reaktion mit Wasser gespalten wird. Dabei werden die Bindungen in der Verbindung durch den Angriff von Wasser aufgelöst, wodurch die ursprüngliche Verbindung in ihre Bestandteile zerlegt wird.
Beispiele
- Hydrolyse-Reaktion von Natriumchlorid (NaCl) in Wasser (H2O): NaCl + H2O -> Na+ + Cl-
- Hydrolyse-Reaktion von Saccharose (C12H22O11) in Wasser (H2O): C12H22O11 + H2O -> C6H12O6 + C6H12O6
- Hydrolyse-Reaktion von Natriumacetat (CH3COONa) in Wasser (H2O): CH3COONa + H2O -> CH3COOH + Na+
- Hydrolyse-Reaktion von Calciumcarbonat (CaCO3) in Wasser (H2O): CaCO3 + H2O -> Ca^2+ + CO3^2-
- Hydrolyse-Reaktion von Ammoniumchlorid (NH4Cl) in Wasser (H2O): NH4Cl + H2O -> NH4+ + Cl-
- Hydrolyse-Reaktion von Aluminiumchlorid (AlCl3) in Wasser (H2O): AlCl3 + 3H2O -> Al(OH)3 + 3HCl
Beispiele aus dem Alltag
Ein praktisches Beispiel für Hydrolyse im Alltag, wäre die Zubereitung von Salzwasser für das Kochen. Wenn Sie Salz in Wasser geben, löst sich das Salz aufgrund der Hydrolyse in seine Ionen (Natriumionen und Chloridionen), wodurch Salzwasser entsteht. Dieses Salzwasser wird häufig zum Kochen von Nahrungsmitteln wie Pasta verwendet, um den Geschmack zu verbessern, da das Salz in Wasser gelöst ist und die Nudeln beim Kochen gut gewürzt werden.
Weitere Beispiele
- Seifenherstellung: Bei der Herstellung von Seife werden Fette oder Öle mit Natronlauge (NaOH) hydrolysiert, wodurch Glycerin und die Salze von Fettsäuren entstehen.
- Verdauung: In unserem Verdauungssystem wird die Nahrung durch Hydrolyse von Enzymen in ihre grundlegenden Bausteine wie Proteine in Aminosäuren, Kohlenhydrate in Zucker und Fette in Fettsäuren und Glycerin umgewandelt.
- Zuckerabbau: Beim Abbau von Zuckerarten wie Saccharose durch Enzyme oder Säuren erfolgt eine Hydrolyse, wodurch die Zucker in ihre einfacheren Bestandteile zerlegt werden.
- Säureregulierung in Lebensmitteln: Die Zugabe von Zitronensäure oder Essigsäure zu Lebensmitteln führt zur Hydrolyse bestimmter Verbindungen, was zu einer Veränderung des pH-Werts und Geschmacks führen kann.
- Abbau von Stärke: In der Wäscherei werden Enzyme verwendet, die Stärke durch Hydrolyse in lösliche Zucker umwandeln, um hartnäckige Stärkeflecken zu entfernen.
Definition: Zerlegung von Molekülen durch Wasser
Die Hydrolyse ist ein chemischer Prozess, bei dem Moleküle mithilfe von Wasser zerlegt werden. Dabei wirken Wassermoleküle direkt auf die chemischen Bindungen der zu spaltenden Substanz ein. Durch diesen Mechanismus werden größere Moleküle in kleinere Bestandteile unterteilt.
Ein einfaches Beispiel wäre die Spaltung eines Esters in eine Säure-Base-Reaktion. In diesem Fall verbindet sich das Wassermolekül mit dem Ester, sodass die ursprünglichen Bindungen zwischen den Atomen verändert und geteilt werden. Dies führt zur Bildung von Alkoholen und Carbonsäuren.
Dieser Prozess lässt sich nicht nur theoretisch beschreiben, sondern findet auch praktisch zahlreiche Anwendungen. Besonders erwähnenswert ist seine Rolle im menschlichen Körper, wo enzymatische Hydrolyse dafür sorgt, dass komplexe Nahrungskomponenten wie Proteine und Kohlenhydrate in ihre einfacheren Formen zerlegt werden. Diese einfachen Formen können dann leichter absorbiert und genutzt werden.
Des Weiteren wird die Methode in verschiedenen Industriezweigen eingesetzt, darunter die pharmazeutische und chemische Produktion. Hier ermöglicht sie die effiziente Herstellung bestimmter Verbindungen aus Rohstoffen durch den gezielten Einsatz von Wasser als Reagenz.
Die Erkenntnis, wie Hydrolyse funktioniert, ist von unschätzbarem Wert für die Chemie und Biologie. – Hermann Emil Fischer
| Anwendungen | Industriezweige |
|---|---|
| Verdauung von Nahrung | Pharmazeutische Produktion |
| Spaltung von Estern | Chemische Produktion |
| Spaltung von Amiden | Lebensmittelindustrie |
| Spaltung von Glykosiden | Forschung und Entwicklung |
Mechanismus: Wasser-Moleküle spalten chemische Bindungen
Bei der Hydrolyse-Reaktion handelt es sich um einen Prozess, bei dem Wasser-Moleküle chemische Bindungen in größeren Molekülen spalten. Das geschieht durch die Anlagerung eines Wassermoleküls an eine bestimmte Bindungsstelle des Zielmoleküls. Dieses Mechanismus verstehen ist entscheidend für viele biologische und industrielle Anwendungen.
Zunächst wird das Wasser-Molekül durch eine chemische Reaktion aktiviert, oft unter Einfluss von Säuren oder Basen. Dadurch entstehen hydronium- (H₃O⁺) oder hydroxid- (OH⁻) Ionen, die die bestehende Bindung im Zielmolekül angreifen können. Bei diesem Angriff kommt es zur Teilung der ursprünglichen Bindung, und neue Bindungen mit den Komponenten des Wassers (H und OH) werden gebildet.
Ein Beispiel dafür wäre die Spaltung eines Esters zu einer Säure und einem Alkohol mittels Wasser und einer Säure als Katalysator. Der Prozess läuft schrittweise ab: Zuerst greift ein Proton der Säure den Sauerstoff des Esters an, wodurch dieser elektronegativer wird und das Kohlenstoffatom anfälliger für den Angriff durch ein Wasser-Molekül macht. Danach folgt die Zerlegung der Bindung zwischen Kohlenstoff und Sauerstoff und schließlich die Neutralisierung des entstehenden Kations durch das verbleibende Hydroxid-Ion.
Diese Prozesse sind zentraler Bestandteil vieler biologischer Mechanismen, wie zum Beispiel der Verdauung. Enzyme wie Amylasen und Lipasen nutzen ähnliche Prinzipien, um Nahrungsmittel in kleinere, verdauliche Einheiten zu zerlegen.
Anwendungen: Verdauung von Nahrung im menschlichen Körper
Die Hydrolyse-Reaktion hat wichtige Anwendungen im Verdauungssystem des menschlichen Körpers. Bei der Verdauung werden große, komplexe Moleküle wie Proteine, Kohlenhydrate und Fette durch Hydrolyse in einfachere Substanzen zerlegt.
Enzyme, die als Biokatalysatoren wirken, spielen dabei eine entscheidende Rolle. Diese Enzyme, wie z.B. Amylase, Pepsin und Lipase, katalysieren den Abbau von Nährstoffen zu kleineren Einheiten. Zum Beispiel wird Stärke durch Amylase in Zucker gespalten, während Proteine durch Pepsin in Aminosäuren zerlegt werden.
Die enzymatische Hydrolyse ist für die Effizienz der Verdauung unverzichtbar, da sie es dem Körper ermöglicht, Nährstoffe aufzunehmen und zu verwerten. Ohne diesen Prozess könnten lebenswichtige Nährstoffe nicht effektiv aus der Nahrung extrahiert werden.
Das Verständnis der Funktionsweise der Hydrolysereaktionen im Verdauungstrakt kann auch bei der Entwicklung neuer Therapien hilfreich sein, insbesondere bei Störungen der Verdauung oder Absorption von Nährstoffen. Deshalb ist die Hydrolysereaktion ein fundamentales Element in vielen medizinischen und ernährungswissenschaftlichen Studien.
Industriezweige: Pharmazeutische und chemische Produktionseinheiten
Die Hydrolyse-Reaktion spielt eine wichtige Rolle in verschiedenen Industriezweigen, insbesondere in den pharmazeutischen und chemischen Produktionseinheiten.
In der pharmazeutischen Industrie wird die Hydrolyse verwendet, um komplexe Moleküle in einfachere Bestandteile zu zerlegen. Dies ermöglicht die Synthese von Wirkstoffen sowie die Herstellung von Medikamenten mit hoher Präzision.
Auch in der chemischen Produktion sind Hydrolyse-Reaktionen von großer Bedeutung. Sie werden genutzt, um Rohstoffe in Zwischenprodukte oder Endprodukte umzuwandeln, die dann weiterverarbeitet oder verkauft werden können. Wichtige Prozesse wie die Spaltung von Estern oder Amiden finden hier Anwendung, was zur Produktion einer Vielzahl von chemischen Verbindungen beiträgt.
Durch die Hydrolyse können Unternehmen effizienter und kostengünstiger produzieren, da Wasser als Lösungsmittel verwendet wird, das in der Regel leicht verfügbar und umweltfreundlich ist. Diese Reaktionen erfordern oft weniger Energie und erzeugen geringere Mengen an Abfallprodukten, was sie besonders attraktiv für industrielle Anwendungen macht.
Typen: Saure, basische und enzymatische Hydrolyse
Es gibt verschiedene Typen der Hydrolyse, die jeweils unterschiedliche Mechanismen und Anwendungen aufweisen. Eine wichtige Kategorie ist die saure Hydrolyse. Hierbei wird Wasser in Anwesenheit einer Säure verwendet, um chemische Bindungen zu spalten. Diese Methode findet oft bei der Herstellung von Kunststoffen oder der Verarbeitung von Lebensmitteln Anwendung.
Ein weiterer wichtiger Typ ist die basische Hydrolyse. In diesem Fall erfolgt die Spaltung durch eine Base. Ein häufiges Beispiel ist die Verseifung von Estern – ein Prozess, der zur Seifenherstellung genutzt wird. Hier reagiert eine Base mit einem Ester, wobei Glycerin und Fettsäuren entstehen.
Schließlich gibt es die enzymatische Hydrolyse, bei der Enzyme anstelle von chemischen Reagenzien als Katalysatoren fungieren. Dies ist besonders in biologischen Systemen relevant, etwa im menschlichen Körper während der Verdauung. Spezifische Enzyme können gezielt Proteine, Kohlenhydrate oder Fette spalten, wodurch Nährstoffe freigesetzt und absorbiert werden können.
Jeder dieser Hydrolysetypen hat seine eigenen Vor- und Nachteile und wird je nach gewünschtem Ergebnis und Anwendungsbereich ausgewählt. Die Auswahl des geeigneten Typs kann stark von den chemischen Eigenschaften der zu hydrolysierenden Substanz sowie den äußeren Bedingungen abhängen.
| Reaktionstyp | Mechanismus | Beispiel |
|---|---|---|
| Saure Hydrolyse | Säure + Wasser | Spaltung von Estern |
| Basische Hydrolyse | Base + Wasser | Verseifung |
| Enzymatische Hydrolyse | Enzyme + Wasser | Verdauung |
Energiebedarf: Variiert je nach Reaktionsbedingungen
Der Energiebedarf bei der Hydrolyse-Reaktion variiert stark und hängt von den spezifischen Reaktionsbedingungen ab. Es ist zu beachten, dass einige Hydrolyse-Reaktionen spontan unter normalen Bedingungen ablaufen können, während andere eine erhebliche Menge an Energie benötigen, um die chemischen Bindungen zu spalten.
Katalysatoren spielen hierbei oft eine entscheidende Rolle. So kann die Anwesenheit eines Enzyms oder einer Säure-Base einen großen Einfluss darauf haben, wie viel Energie notwendig ist, um die Reaktion zu starten und aufrechtzuerhalten. Katalysatoren helfen dabei, die Aktivierungsenergie der Reaktion zu senken, was wiederum den Gesamtenergieaufwand reduziert.
In industriellen Anwendungen wird oft versucht, die Bedingungen so anzupassen, dass weniger Energie benötigt wird. Dies umfasst Maßnahmen wie die Anhebung der Reaktionstemperatur oder -druck sowie die Optimierung des pH-Wertes der Lösung.
Eine saure Hydrolyse beispielsweise erfordert häufig nur moderate Temperaturen, wohingegen die basische Hydrolyse in vielen Fällen höhere Temperaturen als auch längere Reaktionszeiten mit sich bringen kann. Bei enzymatischen Hydrolysen sind die Anforderungen oft strenger, da bestimmte Enzyme nur innerhalb enger Temperatur- und pH-Bereiche effektiv arbeiten.
Zusammengefasst lässt sich sagen, dass je nach gewähltem Ansatz und den spezifischen Reaktanden wesentliche Unterschiede im Energieverbrauch vorliegen können. Daher ist es wichtig, sorgfältig abzuwägen, welche Hydrolysemethode unter den gegebenen Umständen am effizientesten ist.
Umweltfreundliche Prozesse: Minimale Abfallprodukte und Nebenreaktionen
In der industriellen Anwendung von Hydrolyse-Reaktionen spielt die Minimierung von Abfallprodukten und Nebenreaktionen eine zentrale Rolle. Diese Prozesse haben den Vorteil, dass sie durch optimierte Bedingungen oft zu minimalen Abfallprodukten führen, was nicht nur ökologisch, sondern auch ökonomisch vorteilhaft ist.
Ein weiterer Pluspunkt dieser umweltfreundlichen Technologien ist die Reduktion unerwünschter Nebenreaktionen. Weniger Nebenprodukte bedeuten, dass weniger Reinigungsarbeit erforderlich ist und somit die Produktionskosten gesenkt werden können. Zudem wird dadurch der ökologische Fußabdruck verringert.
Besonders in der pharmazeutischen Industrie sowie in der chemischen Produktion sind solche effizienten Verfahren von großer Relevanz. Sie ermöglichen es, reine Produkte herzustellen, ohne dabei unnötige Umweltbelastungen zu verursachen. Dadurch kann das Unternehmen langfristig nachhaltigere Praktiken umsetzen.
Zusätzlich bieten diese umweltfreundlichen Prozesse einen besseren Schutz für die menschliche Gesundheit, da weniger toxische Substanzen freigesetzt werden. Dies trägt dazu bei, dass Arbeitsplätze sicherer werden und die Gesundheitsrisiken für Beschäftigte und Verbraucher sinken. Um diesem Anspruch gerecht zu werden, investieren viele Branchen intensiv in Forschung und Entwicklung zur Verbesserung bestehender Hydrolyse-Methoden.
Beispiele: Spaltung von Estern, Amiden und Glykosiden
Ein bemerkenswertes Beispiel für eine Hydrolyse-Reaktion ist die Spaltung von Estern. Ester sind chemische Verbindungen, bei denen ein Sauerstoffatom zwischen zwei Kohlenstoffatomen gebunden ist. Durch Hydrolyse können diese Verbindungen in ihre Ausgangsstoffe zerlegt werden: ein Alkohol und eine Säure. Dies geschieht gewöhnlich im sauren oder basischen Medium.
Ein weiteres Beispiel sind Amide. Die hydrolytische Spaltung von Amiden führt zu einer Carbonsäure und einem Amin oder Ammoniak. Diese Reaktion findet oft unter stark sauren oder stark basischen Bedingungen statt, um die Bindungen effektiv zu brechen.
Glykoside, komplexe Zuckerverbindungen, sind ebenfalls Ziele der Hydrolyse. Bei der Spaltung von Glykosiden wird das glycosidische Bindung aufgebrochen, was zur Freisetzung eines Zuckermoleküls und eines anderen Moleküls führt, wie einem Alkohol oder Phenol. Dieser Vorgang kommt häufig während der Verdauung vor und trägt zur Energiegewinnung bei.
Durch hydrolytische Prozesse lassen sich vielfältige organische Verbindungen effizient abbauen. Sie sind nicht nur entscheidend in biologischen Systemen, sondern auch in verschiedenen industriellen Anwendungen von großer Bedeutung. Mit der richtigen Wahl der Reaktionsbedingungen können spezifische Produkte zielgerichtet gewonnen werden.