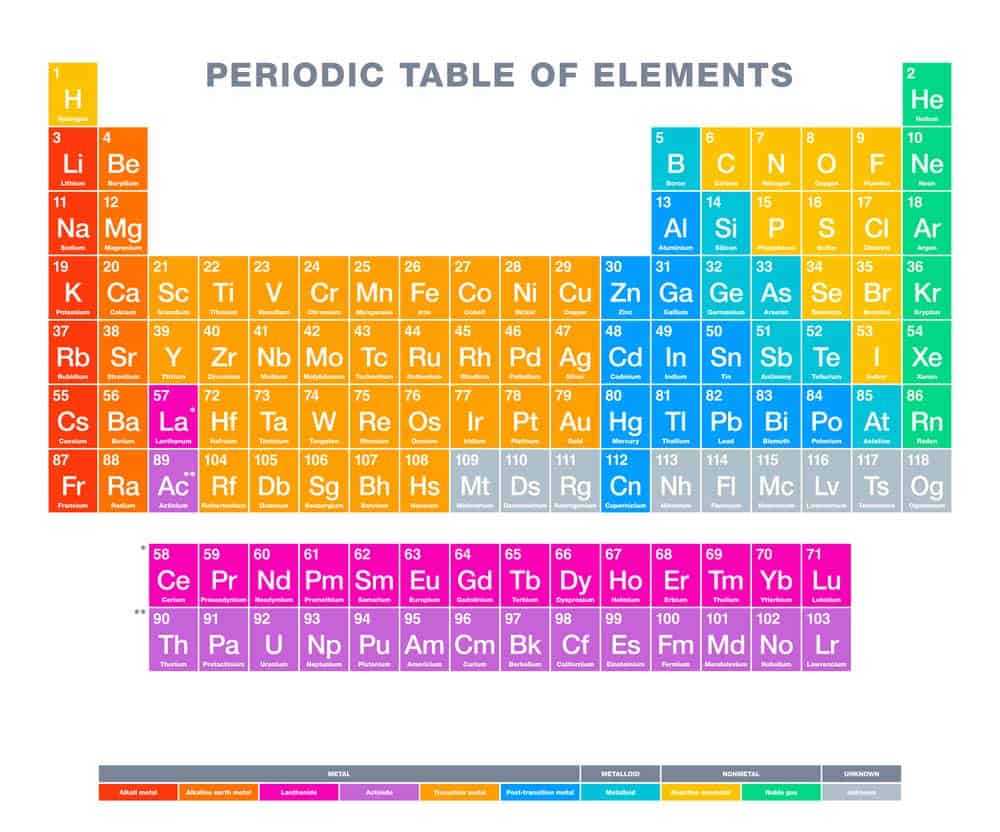
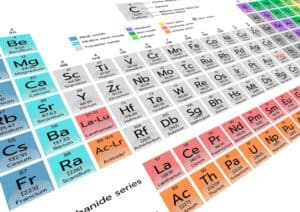
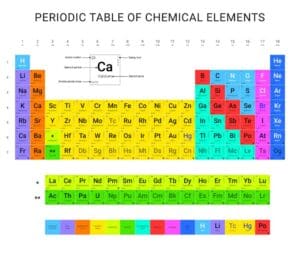
Das Periodensystem ist eine zentrale Komponente der Chemie und bildet die Grundlage für das Verständnis chemischer Elemente. Es beinhaltet verschiedene Gruppen von Elementen, die nach ihren ähnlichen Eigenschaften angeordnet sind. Besonders wichtig sind die Hauptgruppen, da sie grundlegende Informationen über die Elemente bieten und deren Verhalten in chemischen Reaktionen vorhersagbar machen. Insgesamt gibt es acht Hauptgruppen im Periodensystem, die vertikal angeordnet sind und spezifische chemische Charakteristika aufweisen. Diese Gruppierung erleichtert es, die Eigenschaften verschiedener Elemente zu unterscheiden und ihre Interaktionen besser zu verstehen.
Das Wichtigste in Kürze
- Das Periodensystem enthält acht Hauptgruppen mit ähnlichen chemischen Eigenschaften.
- Elemente einer Hauptgruppe haben gleiche Anzahl an Valenzelektronen.
- Hauptgruppen-Elemente zeigen ähnliche chemische Reaktionen.
- Vertikale Spalten im Periodensystem repräsentieren Hauptgruppen.
- Jede Hauptgruppe hat spezifische chemische und physikalische Charakteristika.
Acht Hauptgruppen im Periodensystem
Das Periodensystem der Elemente ist in verschiedene Gruppen unterteilt, um die chemischen Eigenschaften und Reaktionen der Elemente besser zu veranschaulichen. Eine wichtige Kategorie darin sind die Acht Hauptgruppen, die sich durch ähnliche chemische Reaktionen und gemeinsame Eigenschaften auszeichnen.
Diese Hauptgruppen umfassen vertikale Spalten im Periodensystem und beinhalten jeweils Elemente mit ähnlichen elektronischen Konfigurationen in ihren äußeren Schalen. Dadurch zeigen sie oft ähnliche physikalische und chemische Verhaltensweisen, was die Identifikation und das Verständnis dieser Elemente erleichtert.
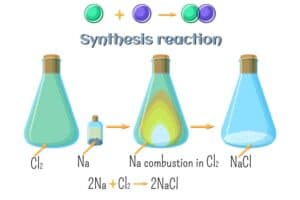
Ein bekanntes Beispiel ist die erste Hauptgruppe, auch als Alkalimetalle bezeichnet. Diese Gruppe umfasst unter anderem Lithium, Natrium und Kalium, die alle besonders reaktionsfreudig sind und typische metallische Eigenschaften wie gute Leitfähigkeit aufweisen.
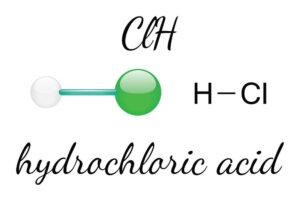
Die Halogene bilden die siebte Hauptgruppe und bestehen beispielsweise aus Fluor, Chlor und Brom. Diese Elemente haben die Fähigkeit, leicht Elektronen aufzunehmen und starke Säuren zu bilden.
Jede dieser Hauptgruppen spielt eine spezielle Rolle in der Chemie und bietet wertvolle Informationen über die Reaktivität und Mischungseigenschaften der Elemente. Dieses Wissen ist nicht nur für Chemiker nützlich, sondern hilft auch in zahlreichen industriellen Anwendungen. Die systematische Anordnung ermöglicht es uns, chemische Prozesse gezielt zu kontrollieren und neue Materialien oder Substanzen gezielt zu entwickeln.
Die Elemente, wenn sie nach ihrer Atomgewichte geordnet sind, weisen eine periodische Wiederholung ihrer Eigenschaften auf. – Dmitri Iwanowitsch Mendelejew
| Gruppe | Beispiele für Elemente |
|---|---|
| 1. Hauptgruppe (Alkalimetalle) | Lithium, Natrium, Kalium |
| 2. Hauptgruppe (Erdalkalimetalle) | Magnesium, Calcium, Barium |
| 3. Hauptgruppe (Borgruppe) | Bor, Aluminium, Gallium |
| 4. Hauptgruppe (Kohlenstoffgruppe) | Kohlenstoff, Silicium, Germanium |
| 5. Hauptgruppe (Stickstoffgruppe) | Stickstoff, Phosphor, Arsen |
| 6. Hauptgruppe (Chalkogene) | Sauerstoff, Schwefel, Selen |
| 7. Hauptgruppe (Halogene) | Fluor, Chlor, Brom |
| 8. Hauptgruppe (Edelgase) | Helium, Neon, Argon |
Gruppierung der Elemente nach chemischen Eigenschaften
Im Periodensystem werden die chemischen Elemente entsprechend ihrer ähnlichen chemischen Eigenschaften gruppiert. Diese Gruppierung ermöglicht es, die Reaktionsweise und die Charakteristika der Elemente innerhalb einer Gruppe leicht zu identifizieren.
Die Hauptgruppen im Periodensystem sind vertikale Spalten, und jede dieser Gruppen enthält Elemente mit ähnlichen Valenzelektronen-Konfigurationen. Dies bedeutet, dass diese Elemente auf ähnliche Weise reagieren und dadurch vergleichbare chemische Verbindungen bilden können. Zum Beispiel sind die Edelgase, die sich in der achten Hauptgruppe befinden, bekannt für ihre geringe Reaktivität aufgrund ihrer vollständig gefüllten Elektronenschalen.
Innerhalb jeder Hauptgruppe zeigen die Elemente eine klare Tendenz in ihrem chemischen Verhalten. So nimmt zum Beispiel die Reaktivität der Alkalimetalle, die in der ersten Hauptgruppe zu finden sind, von oben nach unten zu. Lithium ist bei weitem weniger reaktiv als Francium.
Durch die systematische Ordnung im Periodensystem kann man die chemischen und physikalischen Eigenschaften der Elemente besser verstehen und vorhersagen. Dies erleichtert nicht nur das Lernen über die Elemente, sondern auch deren Anwendung in Wissenschaft und Technik.
| Gruppe | Beispiele für Elemente | Typische Eigenschaften |
|---|---|---|
| 1. Hauptgruppe (Alkalimetalle) | Lithium, Natrium, Kalium | Hohe Reaktivität, geringe Härte |
| 2. Hauptgruppe (Erdalkalimetalle) | Magnesium, Calcium, Barium | Reaktiv, höherer Schmelzpunkt als Alkalimetalle |
| 3. Hauptgruppe (Borgruppe) | Bor, Aluminium, Gallium | Metallische und nichtmetallische Eigenschaften |
| 4. Hauptgruppe (Kohlenstoffgruppe) | Kohlenstoff, Silicium, Germanium | Stabile Verbindungen mit Sauerstoff |
| 5. Hauptgruppe (Stickstoffgruppe) | Stickstoff, Phosphor, Arsen | Bildet stabile kovalente Bindungen |
| 6. Hauptgruppe (Chalkogene) | Sauerstoff, Schwefel, Selen | Starke Oxidationsmittel |
| 7. Hauptgruppe (Halogene) | Fluor, Chlor, Brom | Hohe Elektronegativität, stark säurebildend |
| 8. Hauptgruppe (Edelgase) | Helium, Neon, Argon | Inert, sehr niedrige Reaktivität |
Elemente einer Gruppe zeigen ähnliche Reaktionen
Elemente einer Gruppe im Periodensystem zeigen aufgrund ihrer ähnlichen Elektronenkonfiguration oft ähnliche Reaktionen. Dies bedeutet, dass Elemente derselben Hauptgruppe vergleichbare chemische Eigenschaften aufweisen und in Reaktionen ähnliche Produkte bilden können. Ein klassisches Beispiel hierfür sind die Alkalimetalle der ersten Hauptgruppe: Lithium, Natrium, Kalium und so weiter. Alle diese Metalle reagieren heftig mit Wasser und bilden dabei eine Lauge sowie Wasserstoffgas.
Ein weiteres exemplarisches Verhalten findet sich bei den Halogenen der siebten Hauptgruppe (Fluor, Chlor, Brom, Iod). Diese Nichtmetalle neigen dazu, leicht Elektronen aufzunehmen und damit starke Oxidationsmittel zu sein. In vielen chemischen Prozessen werden sie bevorzugt eingesetzt wegen ihrer Fähigkeit, andere Substanzen effizient zu oxidieren.
Natürlich gibt es innerhalb einer Gruppe Unterschiede, insbesondere hinsichtlich der Reaktionsgeschwindigkeit und -intensität, je nachdem um welches Element es sich handelt. Aber die grundlegenden chemischen Eigenschaften bleiben weitestgehend erhalten, was das Verständnis von chemischen Reaktionen und Verbindungen erheblich erleichtert.
Der vertikale Aufbau des Periodensystems nach Gruppen ermöglicht es daher, Vorhersagen über die Eigenschaften eines Elements basierend auf seiner Position zu treffen. Das erleichtert auch Forschungen und industrielle Anwendungen, indem es verlässliche Rückschlüsse auf das Verhalten neuer oder unbekannter Elemente zulässt.
Vertikale Spalten im Periodensystem
Das Periodensystem der Elemente ist in vertikale Spalten unterteilt, die als Gruppen oder Familien bezeichnet werden. Jede Gruppe im Periodensystem enthält Elemente mit ähnlichen chemischen Eigenschaften, da sie die gleiche Anzahl von Elektronen in ihrer äußersten Schale haben.
Die vertikalen Spalten spielen eine wichtige Rolle bei der Organisation der Elemente. Zum Beispiel befinden sich die Alkalimetalle in der ersten Gruppe und zeigen alle ähnliche Reaktionen mit Wasser. Genauso sind die Halogene in der siebten Gruppe für ihre hohe Reaktivität bekannt.
Ein weiteres wichtiges Merkmal dieser Spalten ist, dass sie dazu beitragen, das Verständnis der elektronischen Struktur der Elemente zu erleichtern. Elemente in derselben Gruppe haben ähnliche Sockelkonfigurationen, was bedeutet, dass sie ähnliche physikalische und chemische Eigenschaften aufweisen.
Die Gruppierung in vertikale Spalten ermöglicht nicht nur eine systematische Übersicht, sondern auch eine einfache Vorhersage der Verhaltensweisen anderer Elemente innerhalb derselben Gruppe. So hilft das Periodensystem dabei, chemische Trends und Muster zu erkennen und besser zu verstehen, wie unterschiedliche Elemente miteinander interagieren.
Durch diese klare Struktur bleibt das Periodensystem ein grundlegendes Werkzeug in der Chemie, das sowohl für Studierende als auch für erfahrene Wissenschaftler nützlich ist.
Jede Hauptgruppe hat spezifische Charakteristika
Jede der acht Hauptgruppen im Periodensystem zeichnet sich durch spezifische Charakteristika aus, die ihre chemischen Eigenschaften und ihr Verhalten in Reaktionen bestimmen. Diese Unterschiede beruhen auf der Anzahl der Valenzelektronen, also den Elektronen, die sich in der äußersten Schale eines Atoms befinden. Die erste Hauptgruppe, auch bekannt als die Alkaliemetalle, enthält Elemente wie Lithium, Natrium und Kalium. Sie sind alle sehr reaktiv, besonders mit Wasser.
Die dritte bis achte Gruppe beinhaltet unter anderem die Erdalkalimetalle, die Borgruppe, die Kohlenstoff- und Stickstoffgruppe sowie die Chalkogene und Halogene. Jede dieser Gruppen weist charakteristische Merkmale auf, wie etwa eine zunehmende Reaktivität innerhalb einer Gruppe von oben nach unten.
Die achte Hauptgruppe, auch Edelgase genannt, umfasst Helium, Neon und Argon. Sie sind bekannt für ihre geringe Reaktivität, da sie eine vollbesetzte Außenschale haben. Dieses Merkmal macht sie ideal für Anwendungen, bei denen Stabilität gefordert ist, beispielsweise in Leuchtstoffröhren und Schutzgasen beim Schweißen.
Auf diese Weise hilft das Verständnis der Hauptgruppen dabei, Vorhersagen über das Verhalten von Elementen zu treffen und deren Einsatzmöglichkeiten zu erkennen.