Chemische Reaktion erkennen
Die Visualisierung und das Verständnis chemischer Reaktionen ist ein zentraler Aspekt der Chemie. Eine chemische Reaktion umfasst mehrere charakteristische Merkmale wie das Ändern von Farbe oder Zustand, das Freisetzen oder Aufnehmen von Energie sowie die Bildung neuer chemischer Verbindungen. Mehrere Faktoren, wie die Reaktionsfreudigkeit von Elementen, spielen dabei eine bedeutende Rolle.
Weitere Anzeichen sind die Gasentwicklung oder Blasenbildung, oft sichtbar durch Prozesse wie die Heterogene Katalyse oder bei bestimmten Exothermen Reaktionen. Auch das Auftreten eines Niederschlags oder Änderungen in der Löslichkeit sind wichtige Indikatoren.
Unterscheidend für chemische Reaktionen ist auch die Irreversibilität vieler Prozesse, von der Molekularen Wechselwirkungen bis hin zur umfassenden Chemischen Synthese; all diese Elemente tragen zur Komplexität und Vielseitigkeit der Chemischen Dynamik bei.
Das Wichtigste in Kürze
- Farbänderung oder Zustandsänderung deutliche Anzeichen für eine chemische Reaktion.
- Reaktionen können Energie freisetzen oder aufnehmen (exotherm/endotherm).
- Neue chemische Verbindungen entstehen durch Brechen und Bilden von Bindungen.
- Gasentwicklung oder Blasenbildung weisen auf chemische Umwandlungen hin.
- Viele chemische Reaktionen sind irreversibel und können nicht rückgängig gemacht werden.
Manche Informationsquellen definieren 4 Schlüsselmerkmale einer chemischen Reaktion als die Bildung neuer Stoffe, den Energieumsatz, die Farbänderung und die Gasentwicklung, da sie diese als entscheidende Indikatoren für eine chemische Reaktion betrachten. Andere Werke fügen der Liste das Merkmal der Temperaturänderung als fünftes wichtiges Element hinzu, da Veränderungen in der Temperatur während einer Reaktion ebenfalls bedeutende Informationen liefern können.
Änderung der Farbe oder des Zustands
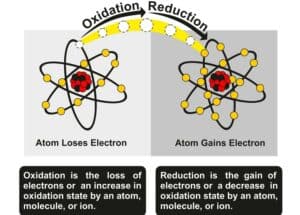
Änderungen der Farbe oder des Zustands sind klare Indikatoren einer chemischen Reaktion. Bei einer solchen Reaktion kann eine Substanz ihre Farbe ändern, was auf die Bildung neuer chemischer Verbindungen hindeutet. Ein klassisches Beispiel ist das Rosten von Eisen, bei dem sich das Eisen aufgrund der Oxidation in verschiedene Eisenoxide umwandelt und diese Verbindung eine bräunliche Farbe annimmt.
Ein weiterer Aspekt ist die Änderung des Aggregatzustands. Zum Beispiel können Stoffe während einer chemischen Synthese von fest zu flüssig wechseln oder Gasblasen bilden. Diese Gasentwicklung kann eine wichtige Rolle dabei spielen, die Chemische Dynamik eines Systems zu verstehen. Die Fähigkeit, Reaktionsprodukte trennen zu können, hängt oft vom neuen Zustand dieser Produkte ab.
Es bedeutet auch, dass man bewusst darauf achten muss, wie diese Veränderungen auftreten. Wenn etwa ein Feststoff in eine Lösung gegeben wird und sich anschließend farbige Blasen bilden, weist dies auf eine chemische Reaktion hin. Beispielsweise kann Heterogene Katalyse dazu führen, dass feste Katalysatoren mit gasförmigen Reaktanten interagieren und dabei sichtbare Farbänderungen verursachen.
In Anbetracht dieser Beobachtungen stellt sich die Frage nach den molekularen Wechselwirkungen, die solche Transformationen hervorrufen. Ebenso ist es möglich, anhand der Gibbs Energie berechnen zu bestimmen, ob die Änderungen spontan stattfinden.
Diese Merkmale verdeutlichen die umfangreiche Reaktionsfreudigkeit von Elementen und bieten Hinweise darauf, wie Homogene Katalyse genutzt werden kann, um gewünschte Ergebnisse effizient zu erzielen.
Chemie ist, wenn es stinkt und kracht. Physik ist, wenn es raucht und leuchtet. — Carl Friedrich von Weizsäcker
| Merkmal | Beschreibung |
|---|---|
| Änderung der Farbe oder des Zustands | Eine Substanz kann ihre Farbe ändern oder ihren Aggregatzustand wechseln, z.B. Rosten von Eisen oder Gasbildung. |
| Freisetzung oder Aufnahme von Energie | Viele chemische Reaktionen sind exotherm (setzen Energie frei) oder endotherm (nehmen Energie auf). |
| Bildung neuer chemischer Verbindungen | Es entstehen neue Stoffe mit anderen chemischen Eigenschaften als die Ausgangsstoffe. |
| Gasentwicklung oder Blasenbildung | Viele Reaktionen, wie z.B. die Heterogene Katalyse, zeigen sichtbare Gasblasenbildung. |
| Niederschlagsbildung oder Löslichkeit | Ein weiterer Indikator ist die Bildung von Feststoffen (Niederschlag) oder Veränderungen der Löslichkeit. |
| Irreversibilität des Prozesses | Viele chemische Reaktionen sind irreversibel, was bedeutet, dass sie nicht ohne weiteres rückgängig gemacht werden können. |
Freisetzung oder Aufnahme von Energie
Die Freisetzung oder Aufnahme von Energie ist ein zentrales Kennzeichen einer chemischen Reaktion. Während eines Reaktionsprozesses wird Energie entweder in Form von Wärme, Licht oder elektrischer Energie freigesetzt oder aufgenommen.
Bei exothermen Reaktionen wird Energie als Wärme an die Umgebung abgegeben. Dies führt häufig zu einem Temperaturanstieg der Reaktionsmischung. Ein alltägliches Beispiel hierfür ist die Verbrennung von Holz, bei der Kohlendioxid und Wasser entstehen und gleichzeitig viel Wärme freigesetzt wird. Exotherme Reaktionen sind daher oft spontan und können durch die Gibbs Energie berechnen bewertet werden.
Im Gegensatz dazu steht die endotherme Reaktion, bei der Energie benötigt wird, um die Produkte zu bilden. Hierbei wird Wärme aus der Umgebung aufgenommen, was oft eine Abkühlung der Reaktionsmischung zur Folge hat. Eine bekannte endotherme Reaktion ist die Zersetzung von Ammoniumnitrat, das bei seiner Auflösung in Wasser Kälte erzeugt.
Der Grad der Energieänderung während einer Reaktion kann auch die Chemische Dynamik beeinflussen, da Teilchen genug Energie benötigen, um ihre Aktivierungsenergie zu überwinden. Weiterhin wirken molekulare Wechselwirkungen stark auf die Effektivität der Energieübertragung während einer Reaktion ein. Durch den Einsatz spezifischer Katalysatoren, wie zum Beispiel bei homogene Katalyse oder heterogene Katalyse, lässt sich die nötige Aktivierungsenergie reduzieren und so der Reaktionsverlauf beschleunigen.
Insgesamt spielt die Energieveränderung eine wichtige Rolle sowohl für die Bewertung der Reaktionsfreudigkeit von Elementen als auch für die genaue Bestimmung der entstehenden Reaktionsprodukte trennen zu können.
| Reaktionstyp | Beispiel | Merkmale |
|---|---|---|
| Exotherme Reaktionen | Verbrennung von Holz | Freisetzung von Wärme, Temperaturanstieg |
| Endotherme Reaktionen | Zersetzung von Ammoniumnitrat | Aufnahme von Wärme, Abkühlung |
| Homogene Katalyse | Reaktion von Schwefeldioxid und Sauerstoff | Gleichmäßige Verteilung des Katalysators, effiziente Energieübertragung |
| Heterogene Katalyse | Hydrierung von Ethylen | Interaktion fester Katalysatoren mit Reaktanten, sichtbare Blasenbildung |
Bildung neuer chemischer Verbindungen
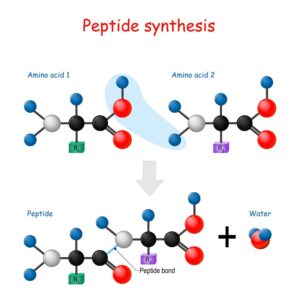
Ein wesentliches Merkmal chemischer Reaktionen ist die Bildung neuer chemischer Verbindungen. Während der Reaktion werden die ursprünglichen Bindungen zwischen Atomen aufgebrochen und neue Bindungen gebildet. Dies führt zur Entstehung von Substanzen mit völlig neuen Eigenschaften im Vergleich zu den Ausgangsstoffen.
Dieser Prozess ist häufig durch eine oder mehrere der folgenden Kennzeichen erkennbar: Änderung der Farbe oder des Zustands; Freisetzung oder Aufnahme von Energie; Gasentwicklung oder Blasenbildung. Ein gutes Beispiel hierfür ist die Synthese von Wasser (H2O) aus Wasserstoffgas (H2) und Sauerstoffgas (O2).
Bei solchen Reaktionen wird oft auch Energie freigesetzt oder absorbiert, was als exotherme bzw. endotherme Reaktion beschrieben wird. Um die thermodynamische Machbarkeit einer Reaktion zu bewerten, kann man die Gibbs Energie berechnen, welche Aufschluss über die Spontaneität der Reaktion gibt.
Die Chemische Dynamik spielt hier ebenfalls eine Rolle, da sie untersucht, wie schnell und in welchem Ausmaß die Stoffe reagieren. Faktoren wie die Reaktionsordnung und die Molekulare Wechselwirkungen beeinflussen maßgeblich die Geschwindigkeit der Bildung neuer Produkte.
Zusätzlich können Katalysatoren – sei es durch homogene Katalyse oder heterogene Katalyse – die Effizienz und Geschwindigkeit der Reaktionen erhöhen. Die Reaktionsfreudigkeit von Elementen sowie deren chemische Eigenschaften bestimmen letztendlich, welche neuen Verbindungen entstehen können.
Zuletzt müssen die entstehenden Reaktionsprodukte trennen werden, um die gewünschten neuen Verbindungen in reiner Form zu isolieren. Diese Schritte sind integral für die Anwendung chemischer Prinzipien in industriellen Prozessen und der chemischen Synthese neuer Materialien.
Gasentwicklung oder Blasenbildung
Ein bedeutendes Kennzeichen chemischer Reaktionen ist die Gasentwicklung oder Blasenbildung. Dies tritt häufig auf, wenn eine chemische Reaktion ein Gas als Nebenprodukt erzeugt. Zum Beispiel wird bei der Reaktion von Essigsäure mit Natriumbicarbonat Kohlenstoffdioxid freigesetzt, welches in Form von Blasen sichtbar wird.
Dieser Prozess kann leicht beobachtet werden und dient oft als visuelles Indiz dafür, dass eine chemische Umwandlung stattfindet. Besonders interessant wird es, wenn man exotherme Reaktionen untersucht, bei denen zusätzlich Wärme freigesetzt wird.
Beispiele für solche Reaktionen sind vielfältig; einige davon spielen eine zentrale Rolle in Alltagssituationen sowie in industriellen Anwendungen. In der Chemischen Synthese etwa werden Gasentwicklungen genutzt, um Prozesse zu überwachen und zu steuern.
Auch bei Experimenten zur Reaktionsordnung und zur Bestimmung molekularer Wechselwirkungen können gasförmige Produkte wichtige Hinweise geben. Diese Phänomene machen es möglich, die Chemische Dynamik besser zu verstehen und präzise Vorhersagen über zukünftige Reaktionen zu treffen.
Die Fähigkeit, durch einfache Beobachtung Gase zu erkennen, ist somit in vielen Bereichen der Chemie von erheblichem Nutzen. Ob es darum geht, die Reaktionsfreudigkeit von Elementen zu untersuchen oder Reaktionsprodukte zu trennen, das Auftreten von Gasblasen bleibt ein unverzichtbares Werkzeug für Chemikerinnen und Chemiker weltweit.
Video: Chemische Reaktionen erkennen – Klasse 8
Video-Link: https://www.youtube.com/watch?v=s17NdP6tRGw
Video: Chemische Reaktion und physikalischer Vorgang I musstewissen Chemie
Niederschlagsbildung oder Löslichkeit
Ein deutliches Merkmal einer chemischen Reaktion kann die Niederschlagsbildung sein, bei der sich ein fester Stoff in einer Lösung bildet. Dies ist häufig das Ergebnis von Molekularen Wechselwirkungen, wenn zwei lösliche Substanzen eine unlösliche Verbindung eingehen. Zum Beispiel entsteht ein weißer Niederschlag aus Bariumsulfat, wenn Bariumchlorid auf Natriumsulfat trifft.
Die Untersuchung der Löslichkeit ist auch wichtig, um die Reaktionsfreudigkeit von Elementen und Verbindungen zu verstehen. Unterschiedliche Substanzen haben unterschiedliche Löslichkeiten in Wasser oder anderen Lösungsmitteln. Diese Eigenschaften werden oft genutzt, um anhand von Löslichkeitsprodukten und wissenschaftlichen Berechnungen wie zur Bestimmung der Gibbs Energie berechnen neue chemische Synthesen durchzuführen.
In Experimenten wird manchmal die Heterogene Katalyse verwendet, bei der der Katalysator und die Reaktanten sich in verschiedenen Phasen befinden. Dies beeinflusst direkt die Bildung eines Niederschlags oder die Löslichkeit der Produkte. Ebenso spielt die Homogene Katalyse eine Rolle, insbesondere wenn es darum geht, Reaktionsprodukte trennen zu müssen, um Reinheit und Effizienz einer Reaktion sicherzustellen.
Durch kontinuierliche Beobachtungen und Messungen dieser Merkmale lässt sich nicht nur die chemische Dynamik einer Reaktion nachverfolgen, sondern auch ihre Reaktionsordnung bestimmen. Somit lässt sich gezielt steuern, wann und wie ein Niederschlag entsteht oder gelöst bleibt, was für viele industrielle und wissenschaftliche Anwendungen von Bedeutung ist.
Irreversibilität des Prozesses
Eine besondere Eigenschaft vieler chemischer Reaktionen ist deren Irreversibilität. Dies bedeutet, dass einmal eingetretene Veränderungen nicht ohne weiteres rückgängig gemacht werden können. Diese Unumkehrbarkeit ist oft durch eine merkliche Änderung der Energiezustände charakterisiert.
Ein Beispiel hierfür sind exotherme Reaktionen, bei denen Wärmeenergie freigesetzt wird. Sobald die Produkte dieser Reaktionen gebildet wurden, wäre es energetisch ungünstig, sie wieder in ihre Ausgangsstoffe zu zerlegen. Ein klassisches Beispiel ist das Verbrennen von Holz; sobald das Holz verbrannt und zu Asche sowie Rauch geworden ist, lässt sich dieser Prozess praktisch nicht mehr umkehren.
Um den irreversiblen Charakter einer Reaktion zu verstehen, kann man auch die Gibbs Energie berechnen. Eine negative Gibbs-Energie indiziert, dass die Reaktion spontan und meist irreversibel abläuft. Solche Prozesse finden häufig in komplexen Systemen wie der chemischen Dynamik statt, wo Reaktionsordnungen und molekulare Wechselwirkungen den Verlauf maßgeblich bestimmen.
Die Irreversibilität beeinflusst zudem die Reaktionsprodukte trennen, sowohl in homogenen als auch heterogenen Katalyseprozessen, was wiederum Auswirkungen auf industrielle Anwendungen und die chemische Synthese hat. Die Reaktionsfreudigkeit von Elementen außerhalb ihres stabilen Zustands spielt ebenfalls eine wichtige Rolle in diesem Zusammenhang, da hoch reaktive Elemente meist teil irreversibler réactions.