Energieänderung – ein Hauptmerkmal von chemischen Reaktionen
Chemische Reaktionen sind zentrale Prozesse, die in der Natur und Technik eine große Rolle spielen. Bei diesen Reaktionen kommt es zu einer Umsetzung von Ausgangsstoffen, bei der Reaktanten zu Produkten werden. Ein wesentlicher Aspekt dieser Vorgänge ist der Energieumsatz.
Während solcher Reaktionen können entweder neue Verbindungen gebildet oder bestehende aufgebrochen werden. Dies führt häufig zur Bildung neuer Moleküle und somit zu einer Veränderung der Stoffzusammensetzung. Das Verständnis dieses Energieumsatzes ist besonders wichtig für die chemische Synthese und die Molekülbildung vieler industriell relevanter Substanzen.
Bei einer exothermen Reaktion wird Wärme an die Umgebung abgegeben, während endotherme Reaktionen diese aus der Umgebung aufnehmen. Diese energetischen Veränderungen begleiten regelmäßig die chemische Umwandlung und Produktbildung. Der gezielte Einsatz von Katalysatoren kann dabei den Energiebedarf erheblich beeinflussen, was sowohl ökonomische als auch ökologische Vorteile mit sich bringt.
Das Wichtigste in Kürze
- Chemische Reaktionen wandeln Reaktanten in neue Produkte um, begleitet von Energieumsatz.
- Exotherme Reaktionen setzen Wärme frei, endotherme nehmen Wärme auf.
- Katalysatoren senken die Aktivierungsenergie und beschleunigen chemische Reaktionen.
- Gibbs’sche freie Energie bestimmt die Spontaneität von Reaktionen.
- Thermodynamische Gesetze regeln Energieerhaltung und Entropiezunahme bei chemischen Prozessen.
Bei chemischen Reaktionen erfolgt ein Energieumsatz, der entweder Wärme absorbiert (endotherm) oder freisetzt (exotherm). Diese Energie kann in Form von Wärme, Licht oder elektrischer Energie auftreten. Der Energieumsatz spielt eine entscheidende Rolle bei der Charakterisierung von Reaktionen und kann durch Temperaturänderungen oder spektroskopische Methoden beobachtet werden.
Beispiele
- Verbrennung von Holz: Bei der Verbrennung von Holz wird chemische Energie in Form von Wärme und Licht freigesetzt, was eine exotherme Reaktion ist.
- Elektrolyse von Wasser: Die Elektrolyse von Wasser erfordert die Zufuhr von elektrischer Energie, daher ist es eine endotherme Reaktion.
- Bildung von Ammoniak: Die Herstellung von Ammoniak durch die Haber-Bosch-Synthese setzt Wärme frei, was eine exotherme Reaktion ist.
- Schmelzen von Eis: Das Schmelzen von Eis zu Wasser erfordert die Aufnahme von Wärmeenergie, also endotherm.
- Neutralisation von Salzsäure mit Natronlauge: Die Neutralisation von Salzsäure mit Natronlauge gibt Wärme ab, daher exotherm.
- Verdampfung von Wasser: Beim Verdampfen von Wasser wird Wärme aufgenommen, also endotherm.
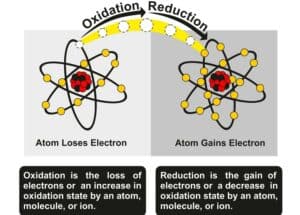
- Oxidation von Eisen: Die Oxidation von Eisen zu Eisenoxid gibt Wärme ab, exotherm.
- Synthese von Wasser: Die Synthese von Wasserstoff und Sauerstoff zu Wasser setzt Wärme frei, exotherm.
- Schmelzen von Natriumchlorid: Das Schmelzen von Natriumchlorid erfordert die Zufuhr von Wärmeenergie, also endotherm.
- Freisetzung von Licht bei der Lumineszenzreaktion: Die Freisetzung von Lichtenergie bei einer chemischen Reaktion ist eine Form des Energieumsatzes.
- Reduktion von Kupferoxid durch Wasserstoff: Die Reduktion von Kupferoxid durch Wasserstoff setzt Wärme frei, exotherm.
- Hydrolyse von Natriumchlorid: Die Hydrolyse von Natriumchlorid in Wasser erfordert die Zufuhr von Wärmeenergie, also endotherm.
Grundlagen des Energieumsatzes in chemischen Reaktionen
Chemische Reaktionen sind Prozesse, bei denen sich neue Verbindungen bilden, indem Atome von Reaktanten zu Produkten umgelagert werden. In diesen Prozessen spielt der Energieumsatz eine entscheidende Rolle. Der Energieumsatz beschreibt die Menge an Energie, die während einer chemischen Synthese freigesetzt oder aufgenommen wird.
Wenn Moleküle miteinander reagieren, müssen zunächst bestehende Bindungen aufgebrochen und neue Bindungen gebildet werden. Das Aufbrechen von Bindungen erfordert Energiezufuhr, während die Bildung neuer Bindungen oft Energie freisetzt. Die Gesamtenergie, die in einem Prozess umgesetzt wird, ergibt sich aus der Differenz zwischen der Energie der zerbrochenen Bindungen und der Energie der neu gebildeten Bindungen.
Ein weiteres wichtiges Konzept ist die exotherme und endotherme Natur chemischer Reaktionen. Exotherme Reaktionen setzen Energie frei, beispielsweise in Form von Wärme, was dazu führt, dass die Umgebungstemperatur steigt. Bei endothermen Reaktionen wird hingegen Energie aufgenommen, meist was die Umgebung abkühlt. Je nachdem, welche Art von Reaktion vorliegt, gestaltet sich der Energiehaushalt der Reaktion unterschiedlich.
Die genaue Berechnung des Energieumsatzes ist essenziell für das Verständnis der Reaktionsdynamik und letztendlich auch für die effiziente Umsetzung von Ausgangsstoffen in neuen Substanzen. Im Verlauf einer Reaktion kann es zur Bildung komplexer Zwischenprodukte kommen, bevor schließlich die neuen Produkte entstehen. Diese neuen Produkte resultieren aus der chemischen Umwandlung und der Veränderung der Stoffzusammensetzung.
In der Chemie gibt es keine Magie, sondern nur logische und erklärbare Prozesse der Umwandlung und Energiezufuhr. – Marie Curie
| Reaktionsart | Beschreibung |
|---|---|
| Exotherm | Reaktionen, bei denen Energie als Wärme an die Umgebung abgegeben wird. |
| Endotherm | Reaktionen, bei denen Energie aus der Umgebung aufgenommen wird. |
Exotherme und endotherme Reaktionen im Überblick
Exotherme und endotherme Reaktionen sind zwei Haupttypen von chemischen Reaktionen, die sich durch den Energieumsatz unterscheiden. Bei exothermen Reaktionen wird Energie an die Umgebung abgegeben. Diese Reaktionen setzen meist Wärme frei und können somit zu einem Temperaturanstieg führen. Ein typisches Beispiel für eine exotherme Reaktion ist die Verbrennung von Holz. Hierbei reagieren Kohlenstoff und Sauerstoff miteinander und erzeugen Kohlendioxid und Wasser sowie reichlich Wärme.
Endotherme Reaktionen hingegen benötigen Energie, um ablaufen zu können. Diese Reaktionen entziehen der Umgebung Wärme, was oft einen Temperaturabfall zur Folge hat. Eine bekannte endotherme Reaktion ist die Fotosynthese, bei der Pflanzen Lichtenergie verwenden, um Kohlendioxid und Wasser in Glukose und Sauerstoff umzuwandeln. In solchen Fällen müssen die Reaktanten mehr Energie aufnehmen als sie freisetzen, um neue Verbindungen zu bilden.
Der Unterschied zwischen exothermen und endothermen Reaktionen liegt im Energiemuster, das während des Prozesses beobachtet wird. Bei beiden Typen entstehen neue Substanzen durch die Umsetzung von Ausgangsstoffen, wobei eine chemische Umwandlung der Moleküle stattfindet. Die daraus resultierende Veränderung der Stoffzusammensetzung führt zur Bildung neuer Moleküle und schließlich zur Produktbildung. Diese verschiedenen energetischen Profile erklären auch, warum einige Reaktionen spontan stattfinden, während andere zusätzliche Energie benötigen.
| Reaktionsbeispiel | Reaktionstyp | Energetische Wirkung |
|---|---|---|
| Verbrennung von Kohlenstoff | Exotherm | Freisetzung von Wärme |
| Fotosynthese | Endotherm | Aufnahme von Lichtenergie |
| Neutralisation von Säuren und Basen | Exotherm | Wärmefreisetzung |
Einfluss von Katalysatoren auf den Energieumsatz
Ein wichtiger Aspekt des Energieumsatzes bei chemischen Reaktionen ist der Einfluss von Katalysatoren. Katalysatoren sind Stoffe, die die Geschwindigkeit einer chemischen Reaktion erhöhen können, ohne dabei selbst verbraucht zu werden. Ihre Hauptfunktion in einer chemischen Reaktion besteht darin, den benötigten Energieaufwand zur Überwindung der sogenannten Aktivierungsenergie zu verringern.
Wenn eine Reaktion stattfindet, müssen die Reaktanten genügend Energie besitzen, um die Aktivierungsbarriere zu überwinden und neue Verbindungen zu bilden. Katalysatoren bieten einen alternativen Reaktionsweg mit niedrigerer Energieanforderung, was die Wahrscheinlichkeit erhöht, dass die Reaktanten zu Produkten reagieren. Dies führt letztendlich zu einer beschleunigten Reaktionsgeschwindigkeit und ermöglicht eine effiziente Umsetzung von Ausgangsstoffen.
Ein praktisches Beispiel dafür ist die Verwendung eines Katalysators bei der chemischen Synthese von Ammoniak durch das Haber-Bosch-Verfahren. Hier wird Eisen als Katalysator eingesetzt, um die Molekülbildung zwischen Stickstoff und Wasserstoff zu erleichtern und so die Bildung neuer Moleküle zu optimieren.
Durch den Einsatz von Katalysatoren wird nicht nur die Produktivität von industriellen Prozessen gesteigert, sondern auch die energetische Effizienz verbessert. Insgesamt spielt der Einfluss von Katalysatoren eine entscheidende Rolle bei der Veränderung der Stoffzusammensetzung und der Produktbildung, da weniger Energie erforderlich ist, um eine erfolgreiche chemische Umwandlung zu erzielen.
Gibbs’sche freie Energie und spontane Prozesse
Die Gibbs’sche freie Energie ist ein zentrales Konzept in der Thermodynamik und beschreibt die nutzbare Energie, die bei einer chemischen Reaktion zur Verfügung steht. Sie bestimmt, ob eine Reaktion spontan abläuft und somit in Richtung der Produktbildung fortschreiten kann.
Eine Reaktion wird als spontan bezeichnet, wenn die Veränderung der Gibbs’schen freien Energie (\( \Delta G \)) negativ ist. Dies bedeutet, dass das System Energie an die Umgebung verlieren kann, wodurch neue Verbindungen entstehen und Reaktanten zu Produkten umgewandelt werden. Diese Art von Umsetzung beeinflusst die Bildung neuer Moleküle wesentlich.
Spontane Prozesse sind oft mit einem Abbau der inneren Energie des Systems verbunden, was zur Freisetzung von Wärme führt. In exothermen Reaktionen tritt genau dies auf: Die entstehende Wärmeenergie trägt zur Stabilität der neuen Substanz bei, die aus der chemischen Synthese resultiert.
Es ist jedoch wichtig zu beachten, dass nicht alle thermodynamisch günstigen Reaktionen (das heißt, solche mit negativem \( \Delta G \)) tatsächlich schnell stattfinden können. Manche benötigen einen zusätzlichen Energiewirkungsgrad oder den Einsatz eines Katalysators, um die Hürde der Aktivierungsenergie zu überwinden. Durch diese chemische Umwandlung wird die Bildung neuer Moleküle beschleunigt, was wiederum zur effizienteren Produktbildung beiträgt.
Insgesamt bietet die Analyse der Gibbs’schen freien Energie wertvolle Einsichten in die Spontanität und Praktikabilität chemischer Reaktionen, wobei immer die Veränderung der Stoffzusammensetzung und die Schaffung neuer Verbindungen im Fokus stehen.
Thermodynamische Gesetze bei chemischen Reaktionen
Thermodynamische Gesetze spielen eine zentrale Rolle bei der Beschreibung des Energieumsatzes in chemischen Reaktionen. Das erste Gesetz der Thermodynamik, auch bekannt als Energieerhaltungssatz, besagt, dass Energie weder geschaffen noch zerstört werden kann – sie kann lediglich von einer Form in eine andere umgewandelt werden.
Bei einer chemischen Reaktion bedeutet dies, dass die Gesamtenergie, die benötigt wird, um Reaktanten zu Produkten umzuwandeln, gleich der Energie ist, die während dieses Prozesses freigesetzt oder absorbiert wird. Dies ist entscheidend für das Verständnis von exothermen und endothermen Reaktionen.
Das zweite Gesetz der Thermodynamik beschreibt, dass die Entropie eines isolierten Systems niemals abnehmen kann. Bei chemischen Reaktionen beeinflusst dies die Richtung, in der die Reaktion spontan ablaufen kann. Eine spontane Reaktion ist durch einen Anstieg der Gesamtentropie im Universum gekennzeichnet.
Die Gibbs’sche freie Energie verbindet diese beiden Gesetze und bietet ein praktisches Werkzeug zur Vorhersage der Spontaneität einer Reaktion. Eine negative Änderung der Gibbs’schen freien Energie zeigt an, dass eine Reaktion unter den gegebenen Bedingungen spontan abläuft.
Diese Gesetze sind nicht nur theoretischer Natur; sie haben direkte Anwendungen in der chemischen Synthese, bei der neue Substanz formen und Moleküle entstehen, sowie in industriellen Prozessen, bei denen die Umsetzung von Ausgangsstoffen zur Produktion neuer Verbindungen führt.