Was ist typisch für eine chemische Reaktion? Die Hauptmerkmale und Nebenmerkmale wissen und erkennen!
Chemische Reaktionen sind zentrale Prozesse, die unser tägliches Leben beeinflussen. Sie ermöglichen es uns, chemische Verbindungen zu schaffen, indem sie Atome neu anordnen und neue Moleküle bilden. Dabei spielen verschiedene Elemente wie der Energieaustausch eine entscheidende Rolle, da bei diesen Prozessen häufig Wärme oder Licht frei wird oder aufgenommen wird.
Während chemischer Reaktionen können sich auch physikalische Eigenschaften der beteiligten Stoffe verändern. Dies zeigt sich beispielsweise durch Farbänderungen, die oft als Indikatoren genutzt werden, oder durch das Auftreten von Gasen oder Niederschlägen. Ein weiteres charakteristisches Merkmal ist die Irreversibilität vieler dieser Prozesse: Sind erst einmal neue Produkte entstanden, lassen sich die ursprünglichen Ausgangsstoffe meist nicht ohne Weiteres wieder zurückgewinnen.
Das Wichtigste in Kürze
- Chemische Reaktionen führen zu neuen Verbindungen durch Umordnung von Atombindungen.
- Energieaustausch in Form von Wärme oder Licht ist charakteristisch.
- Änderungen physikalischer Eigenschaften wie Farbe, Geruch und Aggregatzustand zeigen Reaktionen an.
- Gasentwicklung oder Niederschlagsbildung sind sichtbare Indikatoren.
- Viele chemische Prozesse sind irreversibel und nicht leicht umkehrbar.
Einige Quellen führen 4 Hauptmerkmale einer chemischen Reaktion auf, nämlich die Bildung neuer Stoffe, den Energieumsatz, die Farbänderung und die Gasentwicklung, da sie diese als entscheidende Hinweise auf eine chemische Reaktion betrachten. Andere Quellen ergänzen diese Liste um die Temperaturänderung als ein fünftes bedeutendes Merkmal, da Veränderungen der Temperatur während einer Reaktion ebenfalls wichtige Informationen liefern können.
1. Haupteigenschaft: Stoffumwandlung durch neue chemische Verbindungen
Ein zentrales Merkmal chemischer Reaktionen ist die Stoffumwandlung durch neue chemische Verbindungen. Hierbei werden die Atombindungen innerhalb von Molekülen gebrochen und neu geordnet. Dies führt zur Bildung von Produkten, die sich grundlegend von den Ausgangsstoffen unterscheiden. Ein einfaches Beispiel hierfür ist die Verbrennung von Methan (CH4), bei der Methan mit Sauerstoff reagiert und Kohlendioxid sowie Wasser entsteht. Dieses Prinzip lässt sich auf zahlreiche chemische Vorgänge anwenden.
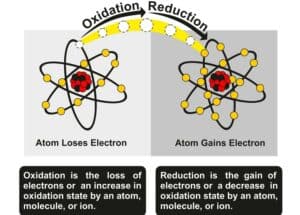
Während dieser Prozesse kann es zu einem Elektronentransfer zwischen Atomen kommen. Dadurch ändern sich auch die Oxidationsstufen der beteiligten Elemente. Solche Umwandlungen sind oft irreversibel und führen dazu, dass völlig neue Substanzen entstehen.
Um eine chemische Reaktion erfolgreich abzuschließen, müssen bestimmte Energiebarrieren überwunden werden. Diese Barrieren können durch das Hinzufügen von Wärme oder Licht überwunden werden. In manchen Fällen ist es notwendig, Katalysatoren zu verwenden, um die Reaktionsgeschwindigkeit zu erhöhen und die gewünschte Produktbildung effizienter zu erreichen.
Chemische Verbindungen schaffen bedeutet nicht nur eine Veränderung auf molekularer Ebene, sondern auch signifikante Unterschiede in den physikalischen Eigenschaften der resultierenden Produkte. Beispiele hierfür sind Änderungen in der Farbe, im Geruch und im Aggregatzustand. Egal ob naturwissenschaftliche Experimente im Labor oder komplexe industrielle Prozesse: Die Stoffumwandlung bleibt ein grundlegendes Phänomen, das unseren Alltag erheblich beeinflusst.
Chemie ist die Kunst, aus einfachen Stoffen neue Verbindungen zu schaffen und damit das Mysterium des Lebens zu ergründen. – Carl Wilhelm Scheele
| Merkmale der chemischen Reaktion | Beschreibung |
|---|---|
| Stoffumwandlung | Es entstehen neue chemische Verbindungen durch das Brechen und Neuanordnen von Atombindungen. |
| Energieaustausch | Wärme oder Licht werden freigesetzt oder aufgenommen. |
| Veränderung physikalischer Eigenschaften | Farben, Aggregatzustände und Gerüche der beteiligten Substanzen verändern sich. |
| Gasentwicklung oder Niederschlagsbildung | Bei manchen Reaktionen entstehen Gase oder feste Niederschläge. |
| Irreversibilität | Die Rückumwandlung in die Ausgangsstoffe ist meistens nicht möglich. |
2. Haupteigenschaft: Energieaustausch in Form von Wärme oder Licht
Ein wesentliches Merkmal einer chemischen Reaktion ist der Energieaustausch, der in Form von Wärme oder Licht auftreten kann. Wenn Atombindungen brechen und neue Chemische Verbindungen schaffen, wird Energie freigesetzt oder aufgenommen, je nachdem, um welche Art von Reaktion es sich handelt.
Bei exothermen Reaktionen wird Energie in Form von Wärme an die Umgebung abgeben. Ein bekanntes Beispiel hierfür ist die Verbrennung von Holz, bei der nicht nur Wärme, sondern oft auch Licht entsteht. Dies bedeutet, dass während der Reaktion mehr Energie frei wird, als benötigt wird, um die Ausgangsstoffe umzusetzen.
Auf der anderen Seite gibt es endotherme Reaktionen, bei denen Energie von außen zugeführt werden muss, damit die Reaktion stattfinden kann. Hierbei absorbieren die Moleküle Energie aus ihrer Umgebung, was oft durch Kühlung dieser Umgebung spürbar ist. Solche Prozesse sind häufig erforderlich, um Moleküle zu transformieren oder Elektronentransfer zu ermöglichen.
Der Austausch von Energie spielt eine entscheidende Rolle in der Produktbildung. Katalysatoren können dazu beitragen, Energiebarrieren zu überwinden und die Reaktionsgeschwindigkeit zu erhöhen, indem sie den benötigten Energieaufwand reduzieren, ohne selbst verbraucht zu werden. Das Verständnis des Energieaustauschs ist somit essentiell für das Verständnis der meisten chemischen Reaktionen.
| Kriterium | Beispiele | Beschreibung |
|---|---|---|
| Stoffumwandlung | Verbrennung von Methan, Photosynthese | Neue chemische Verbindungen entstehen |
| Energieaustausch | Exotherme und endotherme Reaktionen | Wärme oder Licht werden aufgenommen oder abgegeben |
| Sichtbare Veränderungen | Farbänderung, Gasentwicklung | Physikalische Eigenschaften der Substanzen ändern sich |
3. Haupteigenschaft: Farbänderungen als Indikator
Farbänderungen sind ein klarer Hinweis auf das Eintreten einer chemischen Reaktion. Meist resultieren sie daraus, dass sich die chemischen Strukturen verändern und neue chemische Verbindungen schaffen, die andere physikalische Eigenschaften besitzen als die Ausgangsstoffe.
Während einer Reaktion können Moleküle so transformiert werden, dass ihre Farbspektren variieren. Dies ist besonders häufig in Redoxreaktionen der Fall, bei denen ein Elektronentransfer stattfindet und die Oxidationszustände der beteiligten Stoffe wechseln. Durch den Wechsel dieser Zustände ändern sich auch die energetischen Niveaus der Elektronen, was zu einer Farbveränderung führen kann.
Ein klassisches Beispiel hierfür ist die Reaktion von Eisen mit Sauerstoff zu Rost (Eisenoxid). Zu Beginn hat Eisen eine metallisch graue Farbe, wohingegen Rost rötlich-braun erscheint. Diese Veränderung deutet darauf hin, dass neue chemische Bindungen entstanden sind und die ursprünglichen Atombindungen gebrochen wurden. Solche Farbänderungen wie im Falle der Rostbildung können oft irreversibel sein, wodurch sie einen nachhaltigen Hinweis darauf geben, dass eine Produktbildung stattgefunden hat.
Darüber hinaus lässt sich die Reaktionsgeschwindigkeit durch bestimmte Katalysatoren steuern, die wiederum ebenfalls Farbänderungen zeigen können. Dies verdeutlicht, wie vielseitig der Einsatz von Färbungen in der Chemie als Indikator für fortlaufende oder abgeschlossene Prozesse sein kann.
Mithilfe visueller Veränderungen lassen sich also komplexe chemische Abläufe einfacher beobachten und analysieren. So kann beispielsweise der genaue Zeitpunkt bestimmt werden, an dem alle Ausgangsstoffe umgesetzt wurden oder wann Energie freigesetzt wurde.
4. Haupteigenschaft: Gasentwicklung oder Niederschlagsbildung
Ein häufiges Merkmal chemischer Reaktionen ist die Gasentwicklung oder Niederschlagsbildung. Diese Phänomene können oft direkt beobachtet und als Hinweis auf eine chemische Veränderung interpretiert werden.
Bei der Gasentwicklung zeigen sich nach einer Reaktion oftmals Bläschen oder Dämpfe. Dies kann etwa bei der Umsetzung eines Metalls mit einer Säure geschehen, wobei Wasserstoffgas freigesetzt wird. Die entstandenen Gase resultieren aus der Umstrukturierung der Moleküle durch das Brechen alter Atombindungen und das Schaffen neuer chemischer Verbindungen.
Die Niederschlagsbildung tritt hingegen auf, wenn sich in einer Lösung ein unlöslicher Feststoff formt und zu Boden sinkt. Ein gängiges Beispiel hierfür ist die Fällung von Silberchlorid beim Mischen von Silbernitrat- und Natriumchloridlösungen. Diese Art von Produktbildung zeigt klar, dass neue Stoffe entstanden sind, da beide Ausgangsstoffe zuvor vollständig löslich waren.
Um solche chemischen Prozesse effizienter ablaufen zu lassen, kommen oft Katalysatoren zum Einsatz. Sie beschleunigen die Reaktionsgeschwindigkeit, indem sie Energiebarrieren überwinden und somit den Elektronentransfer vereinfachen. Das Ergebnis dieser Transformationen führt zu Veränderungen in den physikalischen Eigenschaften der beteiligten Substanzen, wodurch man visuell miterleben kann, wie Moleküle transformiert werden.
Diese sichtbaren Änderungen wie die Entstehung eines Gases oder eines Niederschlags verdeutlichen nicht nur den Prozess der Chemischen Bindung und Reorganisation, sondern auch die damit verbundene Freisetzung oder Aufnahme von Energie.
Video: Merkmale chemischer Reaktionen – Schulfilm Chemie
Video-Link: https://www.youtube.com/watch?v=PcyxWnqH0mw
4 oder 5 Merkmale bei einer chemischen Reaktion?
Manche Quellen sprechen von 4 Hauptmerkmalen einer chemischen Reaktion, da sie die Bildung neuer Stoffe, den Energieumsatz, die Farbänderung und die Gasentwicklung als die wesentlichen Hinweise auf eine chemische Reaktion betrachten. Andere Quellen erwähnen zusätzlich die Temperaturänderung als ein fünftes wichtiges Merkmal, da Veränderungen der Temperatur während einer Reaktion ebenfalls bedeutsame Informationen liefern können. Es gibt keine feste Regel, ob man von 4 oder 5 Merkmalen spricht, daher kann es je nach Kontext variieren, wie viele Hauptmerkmale einer chemischen Reaktion genannt werden.
5. Merkmal: Temperaturänderung
Die Temperaturänderung ist ein entscheidendes Merkmal einer chemischen Reaktion und wird oft als das fünfte Hauptmerkmal neben der Bildung neuer Stoffe, dem Energieumsatz, der Farbänderung und der Gasentwicklung betrachtet.
Eine Temperaturänderung ist ein bedeutendes Merkmal einer chemischen Reaktion. Während chemische Reaktionen ablaufen, kann es zu einer Freisetzung oder Aufnahme von Energie kommen, die sich in Form einer Temperaturänderung manifestiert. Diese Temperaturänderung kann entweder eine Erwärmung oder Abkühlung der Umgebung bedeuten, abhängig von der Art der Reaktion und dem Energieumsatz.
Die Temperaturänderung in einer chemischen Reaktion ist ein Hinweis darauf, dass eine Reaktion stattfindet und dass chemische Bindungen gebrochen und neu gebildet werden. Eine exotherme Reaktion gibt Wärme an die Umgebung ab und führt zu einer Erwärmung, während eine endotherme Reaktion Wärme aus der Umgebung aufnimmt und zu einer Abkühlung führen kann.
Die Beobachtung einer Temperaturänderung während einer chemischen Reaktion kann auch wichtige Informationen über den Reaktionsverlauf liefern. Sie kann genutzt werden, um Rückschlüsse auf die Energieveränderungen und den Fortschritt der Reaktion zu ziehen. Daher ist die Temperaturänderung ein entscheidendes Merkmal, das bei der Untersuchung und Charakterisierung von chemischen Reaktionen berücksichtigt wird.
Nebenmerkmale: Irreversibilität der chemischen Prozesse
Einige chemische Reaktionen sind irreversibel, was bedeutet, dass sie nicht ohne Weiteres rückgängig gemacht werden können. Diese Eigenschaft ist eng mit der Art und Weise verbunden, wie bei einer chemischen Reaktion Atombindungen brechen und neue Verbindungen entstehen.
Wenn Moleküle transformieren, entsteht oft ein völlig neuer Stoff, der sich in seinen Eigenschaften deutlich von den Ausgangsstoffen unterscheidet. Beispielsweise kann bei einer Verbrennungsreaktion die Energie freigesetzt werden, während die Produkte nicht wieder in ihre ursprüngliche Form zurückgebracht werden können.
Die Irreversibilität wird durch den Elektronentransfer innerhalb der Reaktionspartner unterstützt. Während dieses Vorgangs verschieben sich Elektronen zwischen Atomen, wodurch dauerhafte Veränderungen in der elektronischen Struktur der Moleküle stattfinden. Katalysatoren, die verwendet werden, um die Reaktionsgeschwindigkeit zu erhöhen, beeinflussen zwar die Schnelligkeit der Prozessabläufe, aber nicht die Möglichkeit ihrer Umkehrbarkeit.
Auch die Produktbildung spielt eine zentrale Rolle, denn die neu geschaffenen chemischen Verbindungen haben häufig andere physikalische und chemische Eigenschaften als die Ausgangsstoffe. Die Energiebarrieren, die überwunden werden müssen, um die Produkte zurück in die Ausgangsstoffe umzuwandeln, sind meist sehr hoch, was die Irreversibilität weiter hervorhebt.
Durch die Umsetzung der Ausgangsstoffe in neue Produkte wird letztlich gezeigt, dass viele chemische Prozesse nicht einfach umgekehrt werden können, selbst wenn ausreichende Energie aufgewendet würde.
Nebenmerkmale: Veränderungen physikalischer Eigenschaften
Eines der auffälligsten Merkmale einer chemischen Reaktion ist die Veränderung physikalischer Eigenschaften. Sobald eine chemische Reaktion abläuft, kann man in vielen Fällen beobachten, dass sich bestimmte physikalische Eigenschaften wie Farbe, Geruch, oder Aggregatzustand des Stoffes ändern. Diese Veränderungen sind oft ein deutlicher Hinweis darauf, dass eine Umwandlung auf molekularer Ebene stattgefunden hat.
Ein einfaches Beispiel dafür ist das Verbrennen von Holz: Das feste Material verwandelt sich in Asche (fest) und Rauch (gasförmig), wobei die ursprünglichen physikalischen Eigenschaften nicht mehr vorhanden sind. Dabei kommt es zur Umwandlung der Ausgangsstoffe in neue chemische Verbindungen, was ebenfalls zu einem Wechsel der Dichte, Leitfähigkeit oder auch des Brechungsindex führen kann.
Eine weitere bemerkenswerte Beobachtung ist, dass bei der Entstehung neuer Substanzen in vielen Fällen Wärme freigesetzt oder aufgenommen wird. Dieses Phänomen tritt aufgrund der neu geformten bzw. gebrochenen Atombindungen auf, bei denen Energie entweder als Wärme oder Licht freigesetzt wird. So lassen sich Schlussfolgerungen über die Natur und Energiegehalte der neuen Moleküle ziehen.
Die praktischen Anwendungen dieser Eigenschaften machen sich besonders in Laboren und industriellen Prozessen bemerkbar, wo exakte Messungen der physikalischen Änderungen erforderlich sind, um die Reaktionsgeschwindigkeit und Effizienz der Produktbildung zu kontrollieren. Indem diese Parameter sorgfältig überwacht werden, können Katalysatoren verwendet werden, um die nötigen Energiebarrieren für die Reaktionen zu überwinden und somit effizientere Ergebnisse zu erzielen.