Was ist eine chemische Reaktion einfach erklärt?
Eine chemische Reaktion ist ein Vorgang, bei dem eine oder mehrere Substanzen sich zu neuen Substanzen umwandeln. Während dieses Prozesses ändern sich die chemischen Bindungen der betrokkenen Stoffe, wodurch neue Molekülstrukturen entstehen. Die ursprünglichen Substanzen, die an der Reaktion teilnehmen, werden als Edukte bezeichnet, während die neu gebildeten Stoffe als Produkte bekannt sind.
Reaktionen können sowohl Energie freisetzen als auch aufnehmen. Die Geschwindigkeit einer chemischen Reaktion hängt von verschiedenen Faktoren wie Temperatur und Konzentration ab. Durch das Analysieren reagierender Substanzen und das Aufstellen chemischer Gleichungen kann man diese Prozesse besser verstehen und optimieren.
Das Wichtigste in Kürze
- Chemische Reaktionen verwandeln Edukte durch Bindungsänderungen in neue Stoffe (Produkte).
- Reaktionen sind entweder exotherm (Energie freisetzend) oder endotherm (Energie aufnehmend).
- Katalysatoren beschleunigen Reaktionen, ohne selbst verbraucht zu werden.
- Die Reaktionsgeschwindigkeit wird von Temperatur, Konzentration, Druck und Katalysatoren beeinflusst.
- Edukte und Produkte können durch Gleichungen im stöchiometrischen Verhältnis dargestellt werden.
Eine chemische Reaktion ist ein Prozess, bei dem Ausgangsstoffe miteinander reagieren und neue Stoffe entstehen. In einer chemischen Reaktion werden chemische Bindungen gebrochen und neu gebildet, was zu einer Umwandlung der Ausgangsstoffe führt. Dabei können Energieumsätze, Farbänderungen, Gasentwicklungen und Temperaturänderungen auftreten.
Chemische Bindungen und ihre Veränderungen
Chemische Bindungen spielen eine entscheidende Rolle bei jeder chemischen Reaktion. Eine chemische Bindung stellt die Verbindung zwischen Atomen dar, und während einer Reaktion werden diese Verbindungen entweder gebrochen oder neu gebildet.
Bei der Analyse chemischer Prozesse ist es wichtig, die Veränderungen in den chemischen Bindungen zu verstehen. Solche Veränderungen können durch verschiedene Arten von Bindungen erfolgen, wie kovalente, ionische oder metallische Bindungen. Diese Veränderungen sind oft mit Energieumsetzungen verbunden; je nach Art der Reaktion kann dabei Energie freigesetzt oder aufgenommen werden.
Ein gutes Verständnis der Bindungen hilft auch, die reaktionsfähigen Substanzen korrekt zu analysieren. Denn nur wenn man weiß, welche Bindungen stabil sind und welche leicht brechen oder sich bilden lassen, kann man chemische Gleichungen präzise aufstellen. Dabei berücksichtigt man, wie Atome und Moleküle ihre Bindungen ändern, um von den Edukten zu den Produkten der Reaktionen zu gelangen.
Zusammengefasst: Die Untersuchung der Transformationen in chemischen Bindungen ermöglicht ein tiefes Verständnis der Dynamik von Reaktionen und bietet wertvolle Einblicke in deren Mechanismen.
Die Chemie ist eine Brücke zwischen Physik und Biologie, die es uns erlaubt, die Eigenschaften und Reaktionen der Elemente und Verbindungen zu verstehen. – Carl Djerassi
| Parameter | Beschreibung |
|---|---|
| Reagierende Substanzen analysieren | Durch die Analyse kann festgestellt werden, welche Substanzen in einer Reaktion beteiligt sind und wie sie miteinander interagieren. |
| Chemische Gleichungen aufstellen | Die chemische Gleichung zeigt die Umwandlung von Edukten zu Produkten während einer Reaktion, wobei die beteiligten Atome und Moleküle berücksichtigt werden. |
| Reaktionsbedingungen optimieren | Optimierung der Bedingungen wie Temperatur und Druck kann die Effizienz und Ausbeute einer chemischen Reaktion verbessern. |
| Temperaturauswirkungen | Die Temperatur beeinflusst die Geschwindigkeit, mit der chemische Reaktionen ablaufen. |
| Druckveränderungen | Der Druck kann die Reaktionsgeschwindigkeit und das Gleichgewicht von Reaktionen beeinflussen, insbesondere bei Gasen. |
| Chemische Kinetik | Das Studium der chemischen Kinetik hilft, die Geschwindigkeiten und Mechanismen von Reaktionen zu verstehen. |
| Konzentrationsabhängigkeit | Die Reaktionsgeschwindigkeit kann durch die Konzentration der Edukte und Produkte beeinflusst werden. |
| Oxidationsreaktionen | Reaktionen, bei denen ein Stoff Elektronen abgibt und somit oxidiert wird. |
| Reduktionsprozesse | Reaktionen, bei denen ein Stoff Elektronen aufnimmt und somit reduziert wird. |
| Endothermische Reaktionen | Reaktionen, die Energie in Form von Hitze aufnehmen. |
Edukte und Produkte der Reaktion
In einer chemischen Reaktion werden die am Anfang vorhandenen Substanzen als Edukte bezeichnet. Diese Edukte reagieren miteinander und führen zu neuen Stoffen, die wir als Produkte kennen. Die Art und Weise, wie sich diese Substanzen verändern, lässt sich durch das Konzept der stöchiometrischen Beziehungen erklären.
Beim Analysieren reagierender Substanzen ist es oft notwendig, die chemische Gleichung aufzustellen, die die genauen Mengenverhältnisse der Edukte und Produkte darstellt. Solche Gleichungen sind unerlässlich, um das quantitative Verhältnis zwischen den eingesetzten Ausgangsstoffen und den entstehenden Produkten zu bestimmen.
Die Bedingungen, unter denen eine Reaktion abläuft – wie Temperatur und Druck – können maßgeblich beeinflussen, welche Produkte entstehen. Temperaturauswirkungen spielen insbesondere bei endothermischen und exothermen Reaktionen eine große Rolle, während Druckveränderungen besonders bei Gasreaktionen bedeutsam sein können.
Um spezifische Reaktionen gezielt steuern oder optimieren zu können, ist es nützlich, verschiedene Methoden zur Änderung der Reaktionsbedingungen einzusetzen. Dies kann die Folge haben, dass entweder schneller ein Gleichgewicht erreicht wird oder bestimmte Nebenprodukte vermieden werden.
Das Verständnis der Chemie von Edukten und Produkten ist zentral für viele Anwendungen in Wissenschaft und Technik. Bei der Etablierung effizienter Produktionsprozesse in der Industrie sowie beim Entwickeln neuer Materialien kommt diesem Wissen besondere Bedeutung zu.
| Begriff | Bedeutung | Beispiel |
|---|---|---|
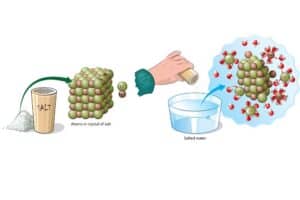
| Edukte | Die Ausgangsstoffe einer chemischen Reaktion | Natrium und Chlor |
| Produkte | Die Stoffe, die durch die chemische Reaktion entstehen | Natruimchlorid (Salz) |
| Katalysator | Eine Substanz, die die Reaktionsgeschwindigkeit erhöht, ohne selbst verbraucht zu werden | Enzyme |
| Aktivierungsenergie | Die Energie, die benötigt wird, um eine chemische Reaktion zu starten | Funken bei einer Zündkerze |
| Gleichgewicht | Ein Zustand, in dem die Vorwärts- und Rückwärtsreaktionen mit gleicher Rate ablaufen | Wasser dissoziiert in Wasserstoff und Sauerstoff |
Energieumsetzung bei Reaktionen
Bei chemischen Reaktionen spielt die Energieumsetzung eine zentrale Rolle. Jede chemische Reaktion geht entweder mit einer Freisetzung oder Aufnahme von Energie einher. Solche Reaktionen, bei denen Wärme abgegeben wird, bezeichnet man als exotherm. Hingegen werden Reaktionen, die Wärme aufnehmen, als endothermisch beschrieben.
Energieumsetzungen können in verschiedenen Formen auftreten – häufig in Form von Wärme, aber auch als Licht oder elektrische Energie. Bei der Verbrennung von Holz beispielsweise handelt es sich um eine exotherme Reaktion, wobei Wärme und Licht freigesetzt werden.
Ein wichtiges Konzept ist hierbei die Aktivierungsenergie, die für den Start vieler Reaktionen notwendig ist. Die energetischen Veränderungen während einer Reaktion lassen sich durch sogenannte Energiediagramme veranschaulichen. In diesen Diagrammen kann man sehen, wie die Energie des Systems vor, während und nach der Reaktion aussieht.
Um bessere chemische Prozesse zu entwickeln, muss man immer wieder die Reaktionsbedingungen optimieren, da Änderungen in Druck und Temperatur starke Auswirkungen auf die Energieumsetzung haben. Beispielsweise kann eine Erhöhung der Temperatur bei endothermischen Reaktionen dazu beitragen, dass diese schneller ablaufen.
Zusammengefasst hat die Art der Energieumsetzung erheblichen Einfluss darauf, wie effizient und schnell eine chemische Reaktion abläuft. Das Verständnis dieser Zusammenhänge ermöglicht es Wissenschaftlerinnen, praktische Anwendungen zu verbessern und neue Materialien oder Verbindungen zu schaffen.
Reaktionsgeschwindigkeit und Einflussfaktoren
Das Tempo, mit dem chemische Reaktionen ablaufen, wird als Reaktionsgeschwindigkeit bezeichnet. Dieses Tempo hängt von mehreren Aspekten ab. Einer der wichtigsten ist die Konzentration der beteiligten Substanzen. Wenn die Konzentration der Edukte erhöht wird, gibt es mehr Teilchen, die miteinander reagieren können, was die Geschwindigkeit der Reaktion erhöht. Dies wird als Konzentrationsabhängigkeit beschrieben.
Ein weiterer wichtiger Punkt ist die Temperaturauswirkungen. Bei höheren Temperaturen bewegen sich die Moleküle schneller, was zu häufigeren und energiereicheren Zusammenstößen führt. Diese Zunahme der kinetischen Energie kann viele Reaktionen beschleunigen. Der Druck hat ebenfalls Einfluss, insbesondere auf Reaktionen, bei denen Gase beteiligt sind. Durch Druckveränderungen lässt sich das Volumen beeinflussen, was wiederum die Häufigkeit von Kollisionen zwischen Teilchen erhöhen kann.
Zusätzlich spielen Katalysatoren eine entscheidende Rolle. Sie beschleunigen Reaktionen, indem sie den benötigten Energieaufwand senken, ohne dabei selbst verbraucht zu werden. Dies ermöglicht schnellere Reaktionsabläufe unter milderen Bedingungen.
Auch die physikalische Beschaffenheit der reagierenden Stoffe spielt eine wesentliche Rolle. Fein verteilte Substanzen haben eine größere Oberfläche und bieten somit mehr Raum für Reaktionen. Die chemische Kinetik hilft uns, all diese Einflüsse besser zu verstehen und die Voraussetzungen zu analysieren und zu optimieren.
Katalysatoren und deren Wirkung
Katalysatoren spielen eine entscheidende Rolle in der Chemie, da sie die Geschwindigkeit chemischer Reaktionen erheblich beeinflussen können. Ein Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit erhöht, ohne dabei selbst verbraucht zu werden. Dies bedeutet, dass der Katalysator nach der Reaktion unverändert bleibt und erneut verwendet werden kann.
Durch die Anwesenheit eines Katalysators wird die Aktivierungsenergie, also die Energie, die benötigt wird, um eine Reaktion zu starten, gesenkt. Dadurch können Reaktionen bei niedrigeren Temperaturen oder unter milderen Bedingungen ablaufen, was oft wirtschaftlich vorteilhaft ist. Einige industrielle Prozesse, wie die Ammoniaksynthese im Haber-Bosch-Verfahren, sind auf Katalysatoren angewiesen, um effizient durchgeführt werden zu können.
Ein Beispiel für einen biologischen Katalysator ist ein Enzym. Enzyme sind Proteine, die biochemische Reaktionen in lebenden Organismen beschleunigen. Sie ermöglichen es den Zellen, Stoffwechselprozesse schnell und präzise durchzuführen.
Zusammenfassend erleichtern Katalysatoren nicht nur die Umsetzung chemischer Reaktionen, sondern machen diese oft erst praktikabel. Ihr Einsatz spielt daher sowohl in der industriellen Produktion als auch in biologischen Systemen eine zentrale Rolle.
Gleichgewichte und irreversible Reaktionen
In der Chemie bezeichnet man das Phänomen, bei dem Vorwärts- und Rückwärtsreaktionen gleichzeitig ablaufen, als chemisches Gleichgewicht. Hierbei bleibt die Konzentration der Edukte und Produkte konstant, obwohl auf molekularer Ebene ständig Reaktionen erfolgen. Um dieses Gleichgewicht besser zu verstehen, ist es hilfreich, reagierende Substanzen zu analysieren und chemische Gleichungen aufzustellen.
Ein klassisches Beispiel für ein chemisches Gleichgewicht ist das von N₂ + 3H₂ ↔ 2NH₃ im Haber-Bosch-Verfahren. Entscheidend für das Erreichen eines Gleichgewichts sind die Reaktionsbedingungen optimieren wie Temperatur, Druck und Konzentration der beteiligten Stoffe. Eine Anpassung dieser Bedingungen, beispielsweise durch Druckveränderungen oder Temperaturauswirkungen, kann das Gleichgewicht in eine gewünschte Richtung verschieben.
Nicht alle Reaktionen verlaufen jedoch reversibel. Es gibt auch irreversible Reaktionen, bei denen die Produkte nicht zurück zu den Edukten reagieren können. Ein häufig genanntes Beispiel ist die Verbrennung von organischen Verbindungen, bei der CO₂ und H₂O entstehen. Weitere irreversible Vorgänge beinhalten viele Oxidationsreaktionen und Reduktionsprozesse, die oft direkt zur Bildung stabiler Endprodukte führen.
Den Unterschied zwischen Gleichgewichtsreaktionen und irreversiblen Reaktionen zu verstehen, ist essentiell für viele praktische Anwendungen in der Chemie, sei es beim Entwickeln neuer Prozesse oder Optimieren bestehender Verfahren. Durch das Studium beider Reaktionstypen können Chemiker effizienter arbeiten und gezielt Einfluss auf die Ergebnisse nehmen.