Bildung neuer Stoffe – ein Hauptmerkmal der chemischen Reaktionen
Die Bildung neuer Stoffe bei chemischen Reaktionen ist ein faszinierendes Gebiet der Chemie, das die Grundlage für viele technische und industrielle Anwendungen bildet. In einer chemischen Reaktion wandeln sich Substanzen, sogenannte Edukte oder Reaktanten, in neue Substanzen, die als Produkte bezeichnet werden, um.
Dabei ändern sich die Bindungen zwischen den Atomen, was oft mit einem Energiewechsel verbunden ist. Solche Reaktionen können entweder exotherm oder endotherm sein, je nachdem ob Energie freigesetzt oder aufgenommen wird. Katalysatoren spielen ebenfalls eine wichtige Rolle, indem sie die Geschwindigkeit der Reaktion erhöhen, ohne selbst verbraucht zu werden.
Chemische Reaktionen sind fundamentale Prozesse, bei denen es zu Stoffumwandlungen durch Änderungen der chemischen Bindungen kommt. Diese Veränderungen können entweder exotherm sein, wobei Energie freigesetzt wird, oder endotherm, wobei Energie benötigt wird, was den Energiehaushalt der Reaktion beeinflusst.
Man unterscheidet verschiedene Typen chemischer Reaktionen, darunter Synthese, Zersetzung und Austausch. Katalysatoren spielen hierbei eine wichtige Rolle, da sie die Reaktionsrate beschleunigen, ohne selbst verbraucht zu werden. Die Darstellung der reagierenden und entstehenden Stoffe erfolgt in Reaktionsgleichungen, die einen genauen Überblick über die beteiligten Substanzen geben.
Verschiedene Einflussfaktoren wie Temperatur, Konzentration und Druck können den Reaktionsablauf entscheidend beeinflussen. Der Einsatz von Enzymkatalyse ist ein weiteres Beispiel dafür, wie biochemische Prozesse effektiv gesteuert werden können.
Das Wichtigste in Kürze
- Chemische Reaktionen wandeln Reaktanten in Produkte durch Umstrukturierung von Atombindungen.
- Exotherme Reaktionen setzen Energie frei, endotherme Reaktionen benötigen Energie.
- Katalysatoren beschleunigen Reaktionen, ohne selbst verbraucht zu werden.
- Die Erhaltung der Masse spielt bei allen chemischen Reaktionen eine zentrale Rolle.
- Reaktionstypen umfassen Synthese-, Verbrennungs- und Zersetzungsreaktionen.
- Chemische Reaktionen sind Stoffumwandlungen durch Änderungen chemischer Bindungen zwischen Atomen.
- Exotherme Reaktionen setzen Energie frei, endotherme Reaktionen benötigen Energiezufuhr.
- Typen chemischer Reaktionen: Synthese, Zersetzung, und Austausch.
- Katalysatoren beschleunigen Reaktionen, ohne selbst verbraucht zu werden.
- Einflussfaktoren: Temperatur, Konzentration und Druck beeinflussen den Reaktionsverlauf.
Bei chemischen Reaktionen findet eine Stoffumwandlung statt, bei der Ausgangsstoffe in neue Stoffe umgewandelt werden. Diese Umwandlung beinhaltet das Brechen und Bilden von chemischen Bindungen, was zu einer Veränderung der chemischen Struktur führt. Die Stoffumwandlung ist ein zentrales Merkmal einer chemischen Reaktion und kennzeichnet den Übergang von den Ausgangsstoffen zu den Produkten.
Definition chemischer Reaktionen: Stoffumwandlung durch Bindungsänderungen
Chemische Reaktionen sind Prozesse, bei denen durch die Umverteilung oder Umstrukturierung von Atombindungen neue Stoffe entstehen. Diese Vorgänge führen zu einer Stoffumwandlung, wobei Ausgangsstoffe (Reaktanten) in Endprodukte umgewandelt werden. Die Änderung der chemischen Bindungen zwischen Atomen während des Reaktionsablaufs ist entscheidend für die Bildung neuer Produkte.
Eine wichtige Eigenschaft chemischer Reaktionen ist das Prinzip der Effektiven Kollisionen. Damit eine chemische Reaktion stattfinden kann, müssen die Teilchen der reagierenden Stoffe mit ausreichender Energie und einer geeigneten Orientierung aufeinandertreffen. Dieser Zustand wird oft als Übergangszustand bezeichnet, in dem alte Bindungen gebrochen und neue formiert werden können.
Im Verlauf des Reaktionsstarts spielen verschiedene Faktoren eine Rolle. Zum Beispiel beeinflussen Temperatur, Druck und die Konzentration der Reaktanten den Reaktionsfortschritt erheblich. Auch Katalysatoren, wie sie häufig in industriellen Prozessen und im menschlichen Körper als Enzyme vorkommen, tragen zur Beschleunigung chemischer Reaktionen bei. Diese Effektive Kollisionen ermöglichen es, dass der Reaktionsverlauf schneller abläuft und weniger Aktivierungsenergie benötigt wird.
Zusammengefasst stellen chemische Reaktionen fundamentale Prozesse dar, bei denen durch Bindungsänderungen neue Stoffe generiert werden. Sie erfordern bestimmte Bedingungen und können durch spezifische Mittel gezielt beeinflusst und gesteuert werden, was vielfältige Anwendungen in der Wissenschaft und Technologie ermöglicht.
Chemische Reaktionen sind Schlüsselelemente unseres Verständnisses der Natur, denn sie enthüllen die verborgenen Mechanismen der Materie. – Linus Pauling
| Begriff | Definition |
|---|---|
| Exotherm | Reaktion, bei der Energie freigesetzt wird |
| Endotherm | Reaktion, bei der Energie aufgenommen wird |
| Effektive Kollisionen | Kollisionen zwischen Teilchen, die zu einer chemischen Reaktion führen |
| Übergangszustand | Zwischenzustand während einer chemischen Reaktion, in dem alte Bindungen gebrochen und neue gebildet werden |
| Reaktionsstart | Beginn einer chemischen Reaktion |
| Reaktionsfortschritt | Fortschreiten der chemischen Reaktion von Anfang bis Ende |
| Reaktionsablauf | Der gesamte Prozess und die Mechanismen einer chemischen Reaktion |
| Enzymkatalyse | Beschleunigung biochemischer Reaktionen durch Enzyme |
| Energieaufnahme | Absorption von Energie während einer chemischen Reaktion |
| Energieabgabe | Freisetzung von Energie während einer chemischen Reaktion |
| Produktcharakterisierung | Beschreibung und Identifikation der entstehenden Produkte einer chemischen Reaktion |
| Reaktionsstechiometrie | Beziehung der Mengenverhältnisse der Reaktanten und Produkte in einer chemischen Reaktion |
Beispiele
- Verbrennung von Methan zu Kohlendioxid und Wasser
- Elektrolyse von Wasser zu Sauerstoff und Wasserstoff
- Fermentation von Zucker zu Alkohol und Kohlendioxid
- Bildung von Salz durch die Reaktion von Natrium und Chlor
- Oxidation von Eisen zu Eisenoxid
- Hydrolyse von Natriumchlorid zu Natriumionen und Chloridionen
- Polymerisation von Ethylen zu Polyethylen
- Bildung von Schwefelsäure durch die Reaktion von Schwefeldioxid, Wasser und Sauerstoff
- Verseifung von Fett zu Glycerin und Seife
Reaktanten und Produkte bei chemischen Reaktionen
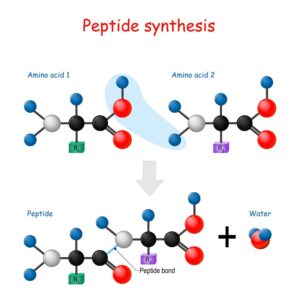
Bei einer chemischen Reaktion reagieren zwei oder mehr Stoffe miteinander, um neue Substanzen zu erzeugen. Diese Ausgangsstoffe werden als Reaktanten bezeichnet, während die neu entstehenden Stoffe als Produkte bekannt sind.
Die Umwandlung geschieht auf molekularer Ebene, wobei die Atome in den Reaktanten ihre Bindungen brechen und neue bilden. Stellen wir uns vor, dass bei einem solchen Prozess eine Verbindung aus Wasserstoff und Sauerstoff entsteht: Hierbei sind die Reaktanten Wassermoleküle und das Produkt ist Wasser.
Ein Beispiel dafür ist die Synthese von Wasser aus Wasserstoff und Sauerstoff:
- Reaktanten: H₂ (Wasserstoff) + O₂ (Sauerstoff)
- Produkt: H₂O (Wasser)
Die Menge der Reaktanten und Produkte lässt sich mithilfe der stöchiometrischen Beziehungen beschreiben, was sicherstellt, dass die Massen sowohl der Reaktanten als auch der Produkte gleich bleiben. Das Konzept der Massenerhaltung spielt hier eine wichtige Rolle: Keine Materie geht verloren oder wird geschaffen; sie wandelt sich nur um.
Zusammengefasst ermöglicht die genaue Kenntnis der beteiligten Reaktanten und Produkte das Verständnis des komplexen Prozesses der Bildung neuer Stoffe bei chemischen Reaktionen.
‚Die Chemie verdeutlicht uns das Prinzip der Umwandlung und der Erhaltung der Materie. Aus Altem wird Neues und nichts geht verloren.‘ – Marie Curie
| Begriff | Erläuterung |
|---|---|
| Reaktanten | Ausgangsstoffe, die in einer chemischen Reaktion reagieren |
| Produkte | Neue Stoffe, die bei einer chemischen Reaktion entstehen |
Umwandlung der Bindungen zwischen Atomen
Die Umwandlung der Bindungen zwischen Atomen ist ein zentrales Merkmal bei der Bildung neuer Stoffe bei chemischen Reaktionen. Während einer solchen Reaktion lösen sich bestehende chemische Bindungen auf, und neue Bindungen werden gebildet. Dadurch entstehen neue Verbindungen mit unterschiedlichen Eigenschaften im Vergleich zu den ursprünglichen Reaktanten.
Atome streben nach einem energetisch stabilen Zustand, was oft durch die Neuordnung von Elektronenpaaren erreicht wird. Dieses Wechselspiel erfordert Energiezufuhr oder gibt Energie in Form von Wärme ab. Der Energiebedarf oder -überschuss hängt von der Art der Bindungen ab, die gebrochen oder gebildet werden.
Ein wesentliches Konzept hierbei ist die Unterscheidung zwischen kovalenten, ionischen und metallischen Bindungen. Jede dieser Bindungsarten hat charakteristische Energieniveaus und Eigenschaften, welche die Stabilität und Reaktivität der Substanzen beeinflussen.
Die Änderung der Bindungen beeinflusst auch die physikalischen Eigenschaften des entstehenden Produkts, wie etwa Schmelz- und Siedepunkte sowie elektrische Leitfähigkeit. Durch das gezielte Management dieser Bindungsumwandlungen können Chemiker maßgeschneiderte Materialien und Verbindungen entwickeln, die für spezifische Anwendungen geeignet sind.
Zusammengefasst ermöglicht die Umwandlung der Bindungen zwischen Atomen während einer chemischen Reaktion die Bildung völlig neuer Stoffe mit einzigartigen Eigenschaften und zeigt die Dynamik naturwissenschaftlicher Prozesse.
| Reaktionstyp | Beispielreaktion | Beschreibung |
|---|---|---|
| Synthesereaktion | 2H₂ + O₂ → 2H₂O | Zwei oder mehr Substanzen verbinden sich zu einem neuen Stoff. |
| Verbrennungsreaktion | CH₄ + 2O₂ → CO₂ + 2H₂O | Eine Substanz reagiert mit Sauerstoff und gibt Wärme ab. |
| Zersetzungsreaktion | 2H₂O₂ → 2H₂O + O₂ | Ein Stoff zerfällt in zwei oder mehr einfachere Substanzen. |
Exotherm und endotherm: Energie wird frei oder benötigt
Bei der Bildung neuer Stoffe bei chemischen Reaktionen spielt der Energiewechsel eine entscheidende Rolle. Eine chemische Reaktion kann entweder exotherm oder endotherm sein.
In einer exothermen Reaktion wird Energie in Form von Wärme an die Umgebung abgegeben. Dies bedeutet, dass die Produkte weniger Energie enthalten als die Reaktanten. Ein klassisches Beispiel ist die Verbrennung von Holz: Dabei wird viel Wärme freigesetzt, was den Raum erwärmt.
Endotherme Reaktionen hingegen erfordern Energiezufuhr aus der Umgebung. Hier sind die Produkte energiereicher als die Ausgangsstoffe. Ein typisches Beispiel ist das Schmelzen von Eis zu Wasser, wobei Wärme aufgenommen wird.
Die Unterscheidung zwischen diesen beiden Arten von Reaktionen ist wichtig, um die energetischen Veränderungen zu verstehen, die während der chemischen Prozesse ablaufen. Diese Unterschiede beeinflussen nicht nur die Reaktionsgeschwindigkeit, sondern auch die Stabilität der resultierenden Substanzen.
Exotherme und endotherme Reaktionen unterscheiden sich hauptsächlich durch die Energie, die während des Prozessablaufs freigesetzt oder aufgenommen wird. Bei einer exothermen Reaktion wird Energie in Form von Wärme an die Umgebung abgegeben.
Ein klassisches Beispiel ist die Verbrennung von Holz oder Benzin. Während dieser Reaktion steigt die Temperatur der Umgebung deutlich an, was auf die Energieabgabe hinweist.
Im Gegensatz dazu stehen endotherme Reaktionen, bei denen Energie benötigt wird, um abzulaufen. Diese Energie muss kontinuierlich von außen zugeführt werden. Ein typisches Beispiel hierfür ist das Schmelzen von Eis, bei dem Wärmeenergie vom Eis aufgenommen wird, um den Übergang von fest zu flüssig zu ermöglichen.
Ob eine chemische Reaktion exotherm oder endotherm ist, hat direkte Auswirkungen auf den Reaktionsfortschritt und den Wärmehaushalt eines Systems. Dieser Unterschied kann auch im Übergangszustand der Reaktanten entscheidend sein. In vielen industriellen Prozessen spielt diese Unterscheidung eine zentrale Rolle und bestimmt maßgeblich die Produktcharakterisierung. Die Energieaufnahme oder -abgabe hängt nicht zuletzt auch von der Reaktionsstechiometrie ab, also dem Verhältnis der reagierenden Stoffe zueinander.
Außerdem können Katalysatoren den Energiewechsel beeinflussen, indem sie die Aktivierungsenergie herabsetzen und so die Reaktion beschleunigen, ohne dabei selbst verbraucht zu werden.
Jede chemische Reaktion führt zu einem Energiewechsel, der entweder durch die Abgabe (exotherm) oder Aufnahme (endotherm) von Energie charakterisiert wird.
| Reaktionstyp | Beispiel | Reaktionsmechanismus |
|---|---|---|
| Synthese | 2H₂ + O₂ → 2H₂O | Neue Bindungen bilden sich zwischen den Reaktanten |
| Zersetzung | 2H₂O → 2H₂ + O₂ | Existierende Bindungen werden aufgebrochen |
| Austausch | AB + CD → AD + CB | Atome oder Gruppen von Atomen werden zwischen Molekülen ausgetauscht |
Beispiele:
Beispiele für exotherme Reaktionen:
- Verbrennung von Holz: Holz reagiert mit Sauerstoff unter Wärmeabgabe, um Kohlendioxid und Wasser zu bilden.
- Kristallisation von Natriumacetat: Die Kristallisation von Natriumacetat aus einer gesättigten Lösung gibt Wärme ab.
- Neutralisation von Salzsäure mit Natronlauge: Die Neutralisation von Salzsäure mit Natronlauge gibt Wärme ab und bildet Salz und Wasser.
Beispiele für endotherme Reaktionen:
- Verdampfung von Wasser: Wasser verdampft bei Wärmezufuhr, um in den gasförmigen Zustand überzugehen.
- Schmelzen von Eis: Eis schmilzt unter Wärmezufuhr, um zu Wasser zu werden.
- Bildung von Ammoniumnitrat: Die Bildung von Ammoniumnitrat aus Ammoniak und Salpetersäure ist eine endotherme Reaktion, die Wärme benötigt.
Typen chemischer Reaktionen: Synthese, Zersetzung, Austausch
Es gibt unterschiedliche Typen chemischer Reaktionen, die zu einer Stoffumwandlung führen: Synthese, Zersetzung und Austauschreaktionen.
Bei der Synthesereaktion werden zwei oder mehr einfache Stoffe zu einem komplexeren neuen Produkt kombiniert. Ein klassisches Beispiel ist die Bildung von Wasser aus Wasserstoff und Sauerstoff (2 H2 + O2 → 2 H2O). Hierbei handelt es sich um eine einfache Art des Reaktionsstarts, bei dem die reagierenden Teilchen zusammengeführt werden, um ein neues Molekül zu bilden.
Die Zersetzungsreaktion ist das Gegenteil der Synthese. Bei dieser Reaktionsart wird eine Verbindung in zwei oder mehrere einfachere Stoffe aufgespalten. Ein typisches Beispiel hierfür ist die Elektrolyse von Wasser, wobei Wasserstoff und Sauerstoff freigesetzt werden (2 H2O → 2 H2 + O2). Diese Art von Reaktion kann sowohl unter Zufuhr von Energie (endotherm) als auch ohne Energiezufuhr (exotherm) ablaufen.
Der letzte Typ sind die Austauschreaktionen. Diese beinhalten den Austausch von Atomen oder Ionen zwischen zwei Verbindungen, wodurch neue Produkte entstehen. Zum Beispiel führt die Reaktion von Salzsäure mit Natriumhydroxid zur Bildung von Wasser und Natriumchlorid (HCl + NaOH → H2O + NaCl). Austauschreaktionen können durch verschiedene Faktoren beeinflusst werden und spielen eine zentrale Rolle im Reaktionsfortschritt vieler industrieller Prozesse.
Beispiele für die verschiedenen Typen chemischer Reaktionen:
Synthese:
- Synthese von Wasser: Wasser entsteht durch die Reaktion von Wasserstoff und Sauerstoff.
- Synthese von Natriumchlorid: Natriumchlorid bildet sich aus der Reaktion von Natrium und Chlor.
- Synthese von Ammoniak: Ammoniak entsteht durch die Reaktion von Stickstoff und Wasserstoff.
Zersetzung:
- Zersetzung von Wasserstoffperoxid: Wasserstoffperoxid zerfällt in Wasser und Sauerstoff.
- Zersetzung von Wasser: Wasser kann durch Elektrolyse in Wasserstoff und Sauerstoff zerlegt werden.
- Zersetzung von Kaliumchlorat: Kaliumchlorat zerfällt beim Erhitzen in Kaliumchlorid und Sauerstoff.
Austausch (Substitutionsreaktion):
- Substitution von Bromwasserstoff: Bromwasserstoff reagiert mit Natriumhydroxid zu Natriumbromid und Wasser.
- Substitution von Methan: Methan kann mit Chlor reagieren, um Chloromethan zu bilden.
- Substitution von Eisen(II)-sulfat: Eisen(II)-sulfat kann mit Natriumhydroxid reagieren, um Natriumsulfat und Eisen(II)-hydroxid zu bilden.
Katalysatoren: Beschleunigung der Reaktionsrate
Ein Katalysator ist eine Substanz, die den Reaktionsablauf einer chemischen Reaktion beschleunigt, ohne dabei selbst verbraucht zu werden. Katalysatoren sind entscheidend für viele industrielle Prozesse sowie biologische Vorgänge.
Katalysatoren spielen eine entscheidende Rolle in vielen chemischen Reaktionen, da sie die Geschwindigkeit dieser Reaktionen deutlich erhöhen können. Ein Katalysator wirkt, indem er den Aktivierungsenergiebedarf der Reaktion herabsetzt. Dadurch wird es den Reaktanten leichter gemacht, in einen Übergangszustand zu gelangen und sich schneller zu Produkten umzuwandeln.
Ein erstaunlicher Aspekt von Katalysatoren ist, dass sie am Ende der Reaktion unverändert bleiben. Das bedeutet, dass sie immer wieder verwendet werden können, ohne selbst aufgebraucht zu werden. Dies macht sie besonders effizient und wirtschaftlich in industriellen Prozessen.
Heterogene Katalysatoren sind oft Feststoffe, die an der Grenzfläche mit flüssigen oder gasförmigen Reaktanten wirken. Ein klassisches Beispiel hierfür wäre ein Autoabgaskatalysator, der schädliche Gase wie Kohlenmonoxid in weniger schädliche Substanzen umwandelt.
Homogene Katalysatoren hingegen befinden sich in derselben Phase wie die Reaktanten, meist in einer Lösung. Sie werden häufig in der Feinchemie benutzt, um präzise und kontrollierte chemische Reaktionen zu ermöglichen.
Zusätzlich können auch biologische Katalysatoren, besser bekannt als Enzyme, genannt werden. Diese Proteine beschleunigen biochemische Prozesse in lebenden Organismen und sind essenziell für das Leben selbst.
Enzymkatalyse ist ein typisches Beispiel, bei dem Enzyme als natürliche Katalysatoren dienen und biochemische Reaktionen in lebenden Organismen erhöhen.
Der Einsatz von Katalysatoren führt zu einem schnelleren Reaktionsstart und beeinflusst den gesamten Reaktionsfortschritt positiv, indem sie die Anzahl der effektiven Kollisionen zwischen den Molekülen erhöhen. Effektive Kollisionen treten auf, wenn Teilchen mit ausreichender Energie und geeigneter Ausrichtung zusammenstoßen, um chemische Bindungen zu brechen oder zu bilden.
Katalysatoren verringern zudem die Aktivierungsenergie der Reaktion, sodass die Moleküle den notwendigen Übergangszustand leichter erreichen können. Dieser Übergangszustand ist ein kurzlebiges Zwischenprodukt, das während des Reaktionsverlaufs auftritt, bevor die endgültigen Produkte entstehen.
Einige praktische Beispiele für katalytisch geförderte Prozesse umfassen die Produktion von Ammoniak durch das Haber-Bosch-Verfahren und die Entstehung von Schwefelsäure im Kontaktverfahren.
Die Verwendung von Katalysatoren kann significant zur Effizienzsteigerung und Energieeinsparung beitragen, da weniger Energie benötigt wird, um die Reaktion abzuschließen.
Beispiele für Katalysatoren, die die Reaktionsrate beschleunigen:
- Platin als Katalysator bei der Oxidation von Wasserstoff zu Wasserstoffperoxid.
- Eisen als Katalysator bei der Haber-Bosch-Synthese zur Ammoniakherstellung.
- Vanadium(V)-oxid als Katalysator bei der Schwefelsäureherstellung durch das Kontaktverfahren.
- Enzyme als biologische Katalysatoren in Stoffwechselprozessen, z.B. Amylase für die Spaltung von Stärke zu Zucker.
- Ruthenium als Katalysator in der industriellen Hydrierung von Alkenen zu Alkanen.
- Platin-Rhodium-Katalysator in Fahrzeugkatalysatoren zur Umwandlung von Schadstoffen in weniger schädliche Gase.
- Nickel als Katalysator in der Hydrogenation von Ölen und Fetten zur Herstellung von Margarine.
- Zinkoxid bei der Reduktion von Schadgasen in Abgasreinigungsanlagen.
- Palladium-Kohlenstoff als Katalysator in der Heck-Reaktion zur Herstellung von Arylverbindungen.
Es ist faszinierend zu beobachten, wie Katalysatoren nicht nur die Effizienz chemischer Prozesse erhöhen, sondern auch einen wesentlichen Beitrag zur Nachhaltigkeit leisten können, indem sie Energie sparen und Abfallprodukte reduzieren.
Video: Stoffumwandlung bei einer chemischen Reaktion
Video-Link: https://www.youtube.com/watch?v=d_mmyRkpuNc
Reaktionsgleichungen: Darstellung reagierender und entstehender Stoffe
Reaktionsgleichungen spielen eine zentrale Rolle bei der Darstellung chemischer Reaktionen. Sie zeigen auf, welche Stoffe zu Beginn einer Reaktion vorhanden sind und welche neuen Stoffe nach Abschluss entstehen. Unterschiedliche Elemente oder Verbindungen werden hierbei durch ihre chemischen Symbole dargestellt. Die Produkte und Edukte sind durch einen Pfeil getrennt, welcher den Reaktionsablauf symbolisiert.
Es ist wichtig, dass die Gleichung ausgeglichen ist – dies bedeutet, dass die Anzahl der Atome jedes Elements auf beiden Seiten des Pfeils identisch ist. Dieser Prozess nennt sich Reaktionsstechiometrie, ein Begriff, der darauf hinweist, dass sowohl Masse als auch Ladung während der chemischen Reaktion erhalten bleiben.
Um das Verständnis zu vertiefen, sollten Beispiele untersucht werden. Etwa die Verbrennung von Methangas:
CH₄ + 2 O₂ → CO₂ + 2 H₂O.
Hier kann man erkennen, wie aus einem Molekül Methan und zwei Molekülen Sauerstoff ein Molekül Kohlenstoffdioxid und zwei Moleküle Wasser entstehen. Ein solcher Zusammenhang macht den Reaktionsstart und -Ende transparent und nachvollziehbar.
Die Darstellungen in Reaktionsgleichungen bieten somit eine klare Sicht auf die beteiligten Substanzen sowie auf deren Produktcharakterisierung. Sie sind dabei nicht nur für theoretische Modelle relevant, sondern auch für praktische Anwendungen in der Chemie essentiell.
Einflussfaktoren: Temperatur, Konzentration, Druck
Temperatur, Konzentration und Druck spielen eine entscheidende Rolle beim Reaktionsablauf chemischer Prozesse. Eine Erhöhung der Temperatur führt in der Regel zu einer schnelleren Reaktion, da die kinetische Energie der Teilchen zunimmt, wodurch effizientere Kollisionen wahrscheinlicher werden. Diese Veränderung hat oft auch einen Einfluss auf den Übergangszustand und kann die benötigte Energieaufnahme oder -abgabe beeinflussen.
Die Konzentration der reagierenden Stoffe hat ebenfalls erheblichen Einfluss auf die Reaktionsgeschwindigkeit. Ein höherer Gehalt erhöht die Wahrscheinlichkeit effektiver Kollisionen zwischen den Teilchen, was wiederum den Reaktionsstart beschleunigen kann. Bei niedrigeren Konzentrationen verlangsamt sich der Reaktionsfortschritt häufig merklich, da weniger Teilchen verfügbar sind, um miteinander zu reagieren.
Druck ist vor allem bei Gasreaktionen von Bedeutung. Durch Erhöhen des Drucks rücken die Gasteilchen dichter zusammen, wodurch auch hier die Anzahl effektiver Kollisionen steigt. Dies wiederum beschleunigt den Reaktionsverlauf. Andererseits kann ein Abfall des Drucks dazu führen, dass der Reaktionsstart verzögert und der gesamte Reaktionsprozess langsamer wird.
Diese drei Faktoren – Temperatur, Konzentration und Druck – sind somit essenziell für die Produktcharakterisierung und die genaue Bestimmung der Reaktionsstechiometrie. Sie bieten vielfältige Möglichkeiten zur Steuerung der Enzymkatalyse und anderer chemischer Prozesse, indem sie direkt den Übergangszustand sowie die Energieaufnahme und Energieabgabe beeinflussen und so den gesamten Reaktionsablauf optimieren.
Erhaltung der Masse und das Gesetz der Stöchiometrie
Die Erhaltung der Masse bei einer chemischen Reaktion ist eine fundamentale Prinzip. Es besagt, dass in einer chemischen Reaktion die Gesamtmasse der Reaktanten gleich der Gesamtmasse der Produkte ist.
Dies bedeutet, dass kein Atom während der Reaktion verloren geht oder auf geheimnisvolle Weise hinzugefügt wird; sie werden lediglich neu angeordnet. Dieses Prinzip steht im Einklang mit dem Gesetz der Stöchiometrie, das besagt, dass die Mengenverhältnisse von Reaktanten und Produkten in einer chemischen Reaktion konstant sind und durch ihre chemischen Formeln bestimmt werden.
Bei jeder chemischen Reaktion können wir daher erwarten, dass die Anzahl der Atome jedes einzelnen Elements auf beiden Seiten der Reaktionsgleichung gleich bleibt. Dies hilft uns nicht nur zu verstehen, wie Reaktionen ablaufen, sondern auch, präzise Berechnungen zur Menge der benötigten Reaktanten und erzeugten Produkte anzustellen.
Wenn beispielsweise Wasser aus Wasserstoff und Sauerstoff gebildet wird, müssen die Massenbilanz und die stöchiometrischen Verhältnisse berücksichtigt werden. Die genaue Kenntnis dieser Aspekte ermöglicht es Chemikern, Vorhersagen darüber zu treffen, wie viel Produkt aus bestimmten Mengen an Reaktanten entstehen kann.
In einem Experiment zeigt sich dies oft durch präzises Abwiegen der Substanzen vor und nach der Reaktion. Selbst wenn eine Teilreaktion sehr kompliziert ist, behält sie doch immer diese grundlegende Reihenfolge der Massen- und Mengenverhältnisse bei.