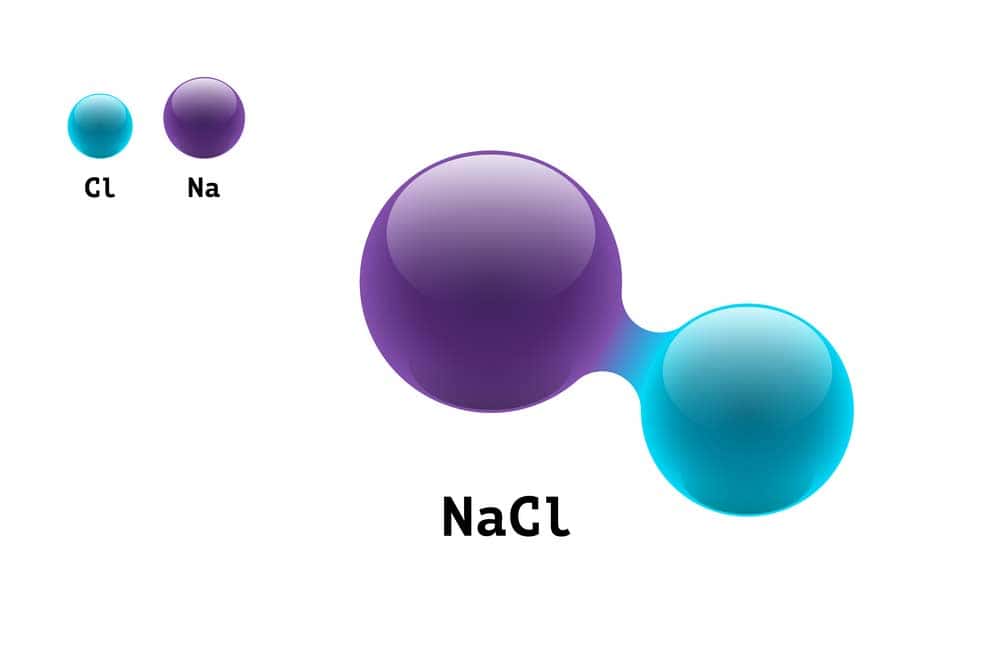
Natriumchlorid (NaCl)
Natriumchlorid ist ein Salz, das aus Natriumionen (Na⁺) und Chloridionen (Cl⁻) besteht. Es ist auch als Kochsalz bekannt und hat viele Anwendungen in der Lebensmittelindustrie, Medizin und anderen Bereichen. Steinsalz ist eine natürliche Form von Natriumchlorid.
Das Wichtigste in Kürze
- Natriumchlorid ist ein Salz, das aus Natrium- und Chloridionen besteht.
- Es hat die chemische Formel NaCl.
- Natriumchlorid bildet regelmäßige Kristallstrukturen.
- Es ist auch bekannt als Kochsalz und wird in der Lebensmittelindustrie verwendet.
- Natriumchlorid hat eine hohe Löslichkeit in Wasser.
- Es spielt eine wichtige Rolle in biologischen Prozessen und im menschlichen Körper.
Natriumchlorid ist in der Chemie eine chemische Verbindung, die aus Natrium- und Chloridionen besteht. Es hat die Formel NaCl und bildet regelmäßige Kristallstrukturen. Natriumchlorid, auch bekannt als Kochsalz, wird in verschiedenen Bereichen wie Lebensmittelindustrie, Medizin und Chemie eingesetzt. Es ist ein wichtiges Salz mit hoher Löslichkeit in Wasser und spielt eine entscheidende Rolle in biologischen Prozessen sowie im menschlichen Körper.
Steckbrief von Natriumchlorid (NaCl)
| Natriumchlorid (NaCl) | Natriumchlorid (NaCl) |
|---|---|
| Chemische Formel | NaCl |
| Struktur | Regelmäßige Kristallstruktur |
| Verwendung | Lebensmittelindustrie, Medizin, Chemie |
| Eigenschaften | Hohe Löslichkeit in Wasser, wichtige Rolle in biologischen Prozessen |
| Bekannt als | Kochsalz |
| Atomstruktur | Natrium: 11 Elektronen, 11 Protonen; Chlor: 17 Elektronen, 17 Protonen |
| Stellung im PSE | Natrium: Gruppe 1, Periode 3; Chlor: Gruppe 17, Periode 3 |
Chemische Formel von Salz: NaCl
Salz, im chemischen Sinne, bezieht sich insbesondere auf die Verbindung Natriumchlorid (NaCl). Diese Substanz ist weitgehend als gewöhnliches Speisesalz bekannt. Natriumchlorid besteht aus Natriumionen (Na+) und Chloridionen (Cl–), die durch eine ionische Bindung zusammengehalten werden.
Die Ionenbindung zwischen den Kationen des Natriums und den Anionen des Chlors führt zu einer stabilen Kristallgitterstruktur. Jeder Natrium- und Chloridion wird dabei von jeweils sechs entgegen geladenen Ionen umgeben. Diese regelmäßige Anordnung sorgt für die charakteristische Härte und Sprödigkeit von Salzkristallen.
Unter natürlichen Bedingungen findet man NaCl häufig in Form von Halite, das auch als Steinsalz bekannt ist. Es bildet große Ablagerungen unter der Erde und ist das Hauptmineral in Salzstöcken. Ein weiteres Beispiel ist Meersalz, das durch die Verdunstung von Meerwasser gewonnen wird. Aufgrund seiner leichten Löslichkeit in Wasser bilden sich leicht Elektrolytlösungen, die in vielen Anwendungen verwendet werden können.
Durch die Auflösung in Wasser entstehen frei bewegliche Natrium- und Chloridionen, die zur elektrischen Leitfähigkeit der Lösung beitragen. Dies macht Salzlösungen zu wichtigen Elektrolyten in physiologischen Prozessen sowie in industriellen Anwendungen.
Salz ist unter allen Edelsteinen, die uns die Erde schenkt, der kostbarste. – Justus von Liebig
| Aspekt | Beschreibung |
|---|---|
| Chemische Formel | NaCl |
| Kristallgitterstruktur | Regelmäßige Anordnung von Na+ und Cl– Ionen |
| Natürliche Vorkommen | Halite, Steinsalz, Meersalz |
| Verwendung | Industrielle Anwendungen, physiologische Elektrolyte |
| Bindungstyp | Ionische Bindung |
| Löslichkeit | Leicht löslich in Wasser |
Arten von Salzen: Halite, Steinsalz, Meersalz
Salze sind wesentliche chemische Verbindungen und gehören zur täglichen Anwendung. Es gibt verschiedene Arten von Salzen, die sich in ihrer chemischen Zusammensetzung und Herkunft unterscheiden.
Halite zum Beispiel ist ein natürlich vorkommendes Mineral, das überwiegend aus Natriumchlorid (NaCl) besteht. Halite bildet oft große transparente oder durchsichtige Kristalle, die auch als Steinsalz bekannt sind. Die Kristallgitterstruktur des Halits sorgt für seine typische kubische Form und ermöglicht einfache Spaltung entlang der Ebenen.
Steinsalz wird hauptsächlich in Salzbergwerken abgebaut und findet in zahlreichen Bereichen Anwendung, insbesondere als Streusalz im Winterdienst. Dank seiner Reinheit spielt Steinsalz auch eine Rolle in der Lebensmittelindustrie.
Meersalz hingegen entsteht durch die Verdunstung von Meerwasser und enthält neben NaCl auch andere Mineralien wie Magnesium und Kalium. Diese zusätzliche Mineralzusammensetzung verleiht Meersalz spezielle Geschmacksnuancen, weshalb es oft in der Gastronomie verwendet wird.
Sowohl Halite als auch Steinsalz und Meersalz haben wichtige Anwendungen: Sie dienen nicht nur als Würzmittel, sondern sind auch essentiell in chemischen Prozessen, darunter Säure-Basen-Reaktionen und die Bildung von Salzlösungen und Elektrolyten. Auch ihre physiologischen Eigenschaften tragen zur Regulation von Flüssigkeitshaushalt und Nervenfunktionen bei.
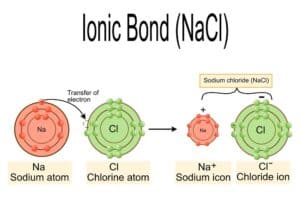
Ionische Bindung in Natriumchlorid
In der Chemie wird das Salz Natriumchlorid, bekannt als NaCl, durch eine ionische Bindung zwischen einem Natrium-Ion (Na⁺) und einem Chlorid-Ion (Cl⁻) gebildet. Diese Art der Bindung entsteht, wenn ein Metallatom Elektronen an ein Nichtmetallatom abgibt. Das Natrium-Atom gibt ein Elektron ab und wird somit zu einem positiv geladenen Ion oder Kation. Gleichzeitig nimmt das Chlor-Atom dieses Elektron auf und wird zu einem negativ geladenen Ion oder Anion.
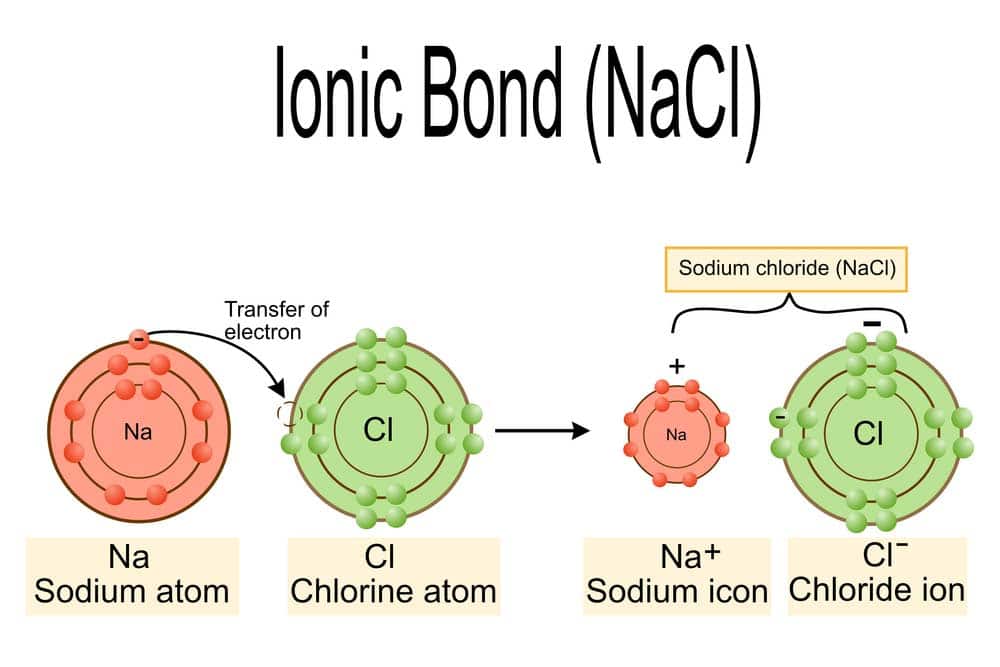
Die entgegengesetzten elektrischen Ladungen erzeugen eine starke elektrostatische Anziehungskraft zwischen den Ionen, die als ionische Bindung bezeichnet wird. In festem Zustand bildet Natriumchlorid ein Kristallgitter, in dem jedes Natrium-Ion von sechs Chlorid-Ionen umgeben ist und umgekehrt – dies nennt man die Kristallgitterstruktur. Dies führt zu einer stabilen Anordnung und zeigt auch die hohe Schmelz- und Siedepunkte von Salzen wie NaCl.
Diese Struktur gibt Natriumchlorid seine typischen Eigenschaften. So ermöglichen die Kationen und Anionen eine bemerkenswerte Leitfähigkeit, sobald sie in Wasser gelöst sind, da die Ionen frei beweglich werden. Dies macht Salzlösungen zu ausgezeichneten Elektrolyten, die Strom leiten können. Solche elektrolytischen Eigenschaften spielen eine wesentliche Rolle bei vielen chemischen Prozessen, einschließlich Säure-Basen-Reaktionen, Titrationen und weiteren Anwendungen in der Analytik.

Herstellung und Gewinnung
Herstellung und Gewinnung von Salz erfolgt auf verschiedene Weisen, die je nach Art des Salzes und der Umgebung variieren. Eine der ältesten Methoden ist das Verdampfen von Meerwasser in flachen Becken. Hierbei verbleibt das feste Salz, nachdem das Wasser verdunstet ist. Diese Methode wird vor allem zur Gewinnung von Meersalz verwendet.
Ein weiterer wichtiger Prozess ist der Abbau von Steinsalz, der aus unterirdischen Lagerstätten gewonnen wird. Dies geschieht durch den Bergbau, bei dem große Mengen an rockformigem Salz abgebaut und anschließend zerkleinert werden. Diese Art des Salzes nennt man Halite und es zeichnet sich durch seine hohe Reinheit aus.
Eine moderne Methode ist die Extraktion mithilfe von Lösung, auch Soleförderung genannt. Bei diesem Verfahren wird Wasser in unterirdische Salzvorkommen gepumpt. Das salzhaltige Wasser (Sole) wird dann wieder an die Oberfläche gebracht und durch Verdunstung oder Sieden wird das Salz isoliert. Durch dieses Verfahren können große Mengen an reinem Salz relativ effizient gewonnen werden.
Die chemische Industrie produziert außerdem spezielle Salze durch chemische Reaktionen. Zum Beispiel entstehen viele Anorganische Salze während der Syntheseprozesse. Natriumchlorid (NaCl), das Kochsalz, kann so hergestellt werden, indem Natronlauge und Salzsäure gemischt werden. In dieser Neutralisationsreaktion bildet sich Salz und Wasser als Nebenprodukt.
Verwendungszwecke und Anwendungen
Salz findet vielfältige Verwendungszwecke und Anwendungen in verschiedensten Bereichen. Ein häufiges Beispiel ist die Verwendung von Kochsalz (Natriumchlorid NaCl) im Haushalt, insbesondere als wichtige Zutat beim Kochen und Würzen von Speisen.
In der Industrie spielt Salz ebenfalls eine bedeutende Rolle. Es wird zur Herstellung von Chemikalien wie Salzsäure und Laugen eingesetzt und dient als Rohstoff für verschiedene industrielle Prozesse. Auch in der Lebensmittelindustrie ist Salz unverzichtbar, etwa bei der Konservierung von Lebensmitteln oder der Herstellung bestimmter Produkte.
Salze sind zudem essenziell für zahlreiche physiologische Prozesse im menschlichen Körper. Sie fungieren als physiologische Elektrolyte und spielen eine Schlüsselrolle bei der Regulierung des Wasserhaushalts sowie der Erhaltung der Zellfunktion.
Darüber hinaus verwendet man Salze wegen ihrer hygroskopischen Eigenschaften in verschiedenen technischen und wissenschaftlichen Anwendungen. Hygroskopische Salze werden in Trocknungsmitteln eingesetzt, um Feuchtigkeit zu absorbieren und kontrollierte Umgebungen zu schaffen.
Im Winterdienst nutzt man Natriumchlorid als Streusalz, um Eisbildung auf Straßen und Wegen zu verhindern. Dies verbessert die Sicherheit und Mobilität während kalter Jahreszeiten erheblich.
In der Landwirtschaft kommen spezielle Salzmischungen zum Einsatz, um den Boden zu düngen und Pflanzen mit notwendigen Nährstoffen zu versorgen. Hierbei können sowohl anorganische als auch organische Salze genutzt werden.
| Kategorie | Eigenschaft | Beispiel |
|---|---|---|
| Physikalische Eigenschaften | Schmelz- und Siedepunkt | NaCl hat einen hohen Schmelzpunkt |
| Chemische Eigenschaften | Reaktivität | NaCl reagiert mit Silbernitrat |
| Biologische Bedeutung | Elektrolyt-Regulation | NaCl in der Blutbahn |
| Industrielle Anwendungen | Rohstoff | Verwendung in der Chlorproduktion |
| Umweltaspekte | Hygroskopische Eigenschaft | Feuchtigkeitsaufnahme aus der Luft |
Natürliche Vorkommen von Salz
Salz kommt in der Natur in verschiedenen Formen vor. Eine der häufigsten natürlichen Erscheinungsformen ist Halite, auch bekannt als Steinsalz. Es bildet sich durch die Ausfällung von NaCl aus verflüssigten Ablagerungen, oft nach dem Verdunsten antiker Meeresbecken. Diese Kristallgitterstruktur des Halits macht es zu einem wichtigen Rohstoff.
Meersalz wird hingegen direkt durch das Verdampfen von Meerwasser gewonnen. In Salinen lässt man flaches Wasser in großen Becken stehen, bis nur noch das Salz zurückbleibt. Diese Methode nutzt die Tatsache, dass Salzlösungen und Elektrolyte in Wasser eine hohe Konzentration erreichen können, bevor sie kristallisieren.
Eine weitere natürliche Quelle sind Salzstöcke, unterirdische Lagerstätten, die durch tektonische Bewegungen an die Oberfläche gedrückt wurden. Diese Salzvorkommen enthalten große Mengen reinen Natriumchlorids.
In Wüstengebieten findet man außerdem Salzkrusten auf der Erdoberfläche. Diese entstehen durch den kapillaren Aufstieg von gelösten Salzen aus dem Grundwasser, gefolgt von der Verdunstung des Wassers. Solche Krusten sind nicht nur für die lokale Umwelt interessant, sondern werden auch industriell genutzt.
Natürliche Salzquellen spielen auch eine entscheidende Rolle im physiologischen Bereich, da Salz unabdingbar für viele biologische Prozesse und physiologische Elektrolyte ist. Beispielsweise reguliert es den Wasserhaushalt im Körper und beeinflusst die Funktion von Nervenzellen.
Vorkommen auf der Erde von Natriumchlorid
- Meerwasser
- Salzseen
- Salzminen
- Salzablagerungen in Gesteinsschichten
- Unterirdische Salzlagerstätten
- Salzpfannen
Gesundheitliche Auswirkungen
Natriumchlorid NaCl, auch bekannt als Kochsalz, spielt eine zentrale Rolle in der menschlichen Ernährung und im Flüssigkeitshaushalt des Körpers. Es ist wichtig, weil es physiologische Elektrolyte zur Verfügung stellt, die für die Funktion von Zellen, Nerven und Muskeln notwendig sind.
Zu viel Salz kann jedoch gesundheitsschädlich sein. Ein hoher Salzkonsum erhöht das Risiko von Bluthochdruck, was wiederum Herz-Kreislauf-Erkrankungen begünstigen kann. Außerdem kann zu viel Salz die Nieren belasten und langfristig zu Nierenschäden führen.
Auf der anderen Seite kann ein Mangel an Natrium ebenfalls problematisch sein. Symptome von Natriummangel umfassen Muskelkrämpfe, Schwindel und sogar neurologische Störungen. Eine ausgewogene Aufnahme von Salz ist daher essenziell für die Aufrechterhaltung der Gesundheit.
Salz wird oft verarbeitetem Lebensmitteln zugesetzt, weshalb es wichtig ist, den Salzgehalt auf Verpackungen zu überprüfen. Daher empfiehlt die Weltgesundheitsorganisation (WHO), die tägliche Aufnahme von Natrium zu begrenzen, um diese gesundheitlichen Risiken zu minimieren.
Zusätzlich hat Salz hygroskopische Eigenschaften, was bedeutet, dass es Wasser anzieht und somit dazu beitragen kann, bestimmte Lebensmittel länger haltbar zu machen. Dies ist besonders nützlich bei der Konservierung von Fleisch, Fisch und anderen verderblichen Waren.
Industrielle und alltägliche Bedeutung
Die Anwendung von Salz reicht weit über den häuslichen Gebrauch hinaus und spielt eine entscheidende Rolle in zahlreichen Industriezweigen. In der chemischen Industrie dient Natriumchlorid zur Herstellung von Produkten wie Chlor, Natronlauge und Wasserstoff. Diese Chemikalien sind Grundstoffe für die Synthese vieler anderer Verbindungen.
Ein weiteres Anwendungsfeld ist die Nahrungsmittelindustrie, wo Salz nicht nur als Gewürz, sondern auch als Konservierungsmittel verwendet wird, um die Haltbarkeit von Lebensmitteln zu verlängern. Die Bedeutung von physiologischen Elektrolyten und ihrer Fähigkeit, Leitfähigkeit in wässriger Lösung zu ermöglichen, ist hierbei von besonderem Interesse.
Darüber hinaus wird Salz im Winterdienst genutzt, um Straßen eisfrei zu halten. Die hygroskopischen Eigenschaften des Salzes spielen dabei eine wichtige Rolle, da es Feuchtigkeit aus der Luft zieht und so das Eis schneller schmelzen lässt.
In der Landwirtschaft kommt Salz als Düngerzusatz zum Einsatz, um bestimmte Mineralien anzureichern und somit den Ertrag zu steigern. Auch in der Textilindustrie findet man Anwendungen für Natriumchlorid, beispielsweise bei der Färbung von Stoffen.
Die Verwendungsmöglichkeiten von Salz sind vielseitig und weisen auf seine hohe wirtschaftliche Relevanz hin. Von der Halite-Mineralogie bis zu seiner Funktion in verschiedenen chemischen Prozessen – Salz bleibt ein unverzichtbarer Bestandteil zahlreicher Alltags- und Industriebereiche.
Industrielle Bedeutung:
- Verwendung in der Lebensmittelindustrie zur Konservierung und Geschmacksverbesserung
- Herstellung von Chlor und Natriumhydroxid in der chemischen Industrie
- Einsatz als Schmelzsalz in der Metallurgie
- Verwendung in der Papier- und Textilindustrie
Alltägliche Bedeutung:
- Kochen und Würzen von Speisen
- Verwendung als Auftau- und Streusalz im Winter
- Herstellung von Solelösungen für medizinische Anwendungen
- Reinigung und Pflege von Kontaktlinsen