Die chemischen Elemente werden üblicherweise in alphabetischer Reihenfolge aufgelistet, um eine einfache und klare Übersicht zu gewährleisten. In dieser Referenzliste befinden sich alle wichtigen Informationen zu den verschiedenen Elementen aus dem Periodensystem, einschließlich ihrer spezifischen Bezeichnungen und Eigenschaften.
Ein besonderes Element mit dem Buchstaben „D“ ist Deuterium. Als isotopische Form des Wasserstoffs nimmt Deuterium eine bedeutende Rolle innerhalb der chemischen Nomenklatur ein. Es zeichnet sich durch spezielle physikalische und chemische Merkmale aus und wird in zahlreichen industriellen sowie wissenschaftlichen Anwendungen genutzt.
Das Wichtigste in Kürze
- Deuterium ist ein stabiles Isotop des Wasserstoffs mit einem Neutron im Kern.
- Es macht etwa 0,015% des gesamten Wasserstoffs auf der Erde aus.
- Wird als Moderator in Kernreaktoren und in der Fusionsforschung verwendet.
- Wichtige Anwendungen in der Spektroskopie und biochemischen Untersuchungen.
- Erzeugung durch Elektrolyse von schwerem Wasser oder Destillation von Wasserstoff.
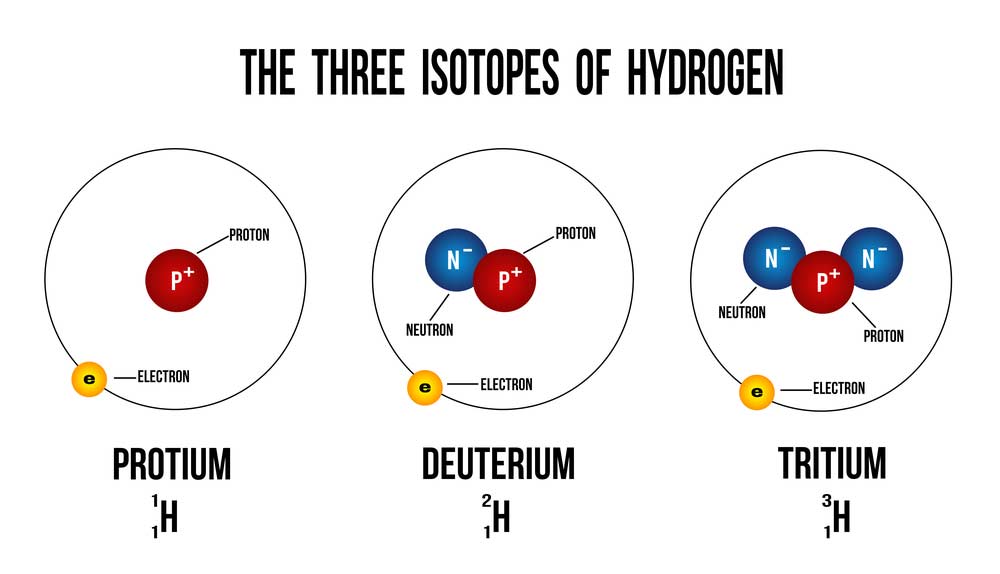
Wasserstoff hat drei Isotope, nämlich Protium (H-1), Deuterium (H-2) und Tritium (H-3), die sich in der Anzahl der Neutronen im Kern unterscheiden, aber alle die gleiche Ordnungszahl im Periodensystem haben.
Einführung in die Eigenschaften von Deuterium
Deuterium, auch als schwerer Wasserstoff bekannt, ist ein stabiles Isotop des Wasserstoffs. Es hat im Vergleich zum häufigeren Wasserstoffisotop Proton zusätzlich zu einem Proton im Kern ein Neutron. Diese einfache Strukturänderung führt zu einigen bemerkenswerten physikalischen und chemischen Eigenschaften.
Deuterium hat eine Atommasse von ungefähr 2,014 u, was fast doppelt so viel wie die des gewöhnlichen Wasserstoffs (~1,008 u) ist. Trotz dieser massiven Unterscheidung sind die chemischen Eigenschaften von Deuterium denen des normalen Wasserstoffs sehr ähnlich. Dies verleiht Deuterium jedoch charakteristische Unterschiede in Bereichen wie Reaktionsgeschwindigkeit und Bindungsstärke.
Seine Schwerigkeit beeinflusst verschiedene physikalische Eigenschaften von Verbindungen, in denen es vorkommt. Zum Beispiel hat schweres Wasser (D₂O) einen höheren Siedepunkt als normales Wasser (H₂O).
Da Deuterium seltener vorkommt als das gewöhnliche Wasserstoff-Isotop, spielt es spezifische Rollen in wissenschaftlichen Experimenten und Anwendungen. Insbesondere in der Nuklear- und Spektroskopietechnik sind solche speziellen Eigenschaften von entscheidendem Vorteil. Zudem wird Deuterium oft als Tracer in biochemischen Untersuchungen eingesetzt, um Mechanismen komplexer Stoffwechselprozesse nachzuvollziehen.
Es ist die Einfachheit des Atoms und die Fülle an Verwendungsmöglichkeiten, die Deuterium zu einem unschätzbaren Werkzeug in der Wissenschaft machen. – Harold Urey
Vorkommen von Deuterium in der Natur
Deuterium, auch bekannt als schwerer Wasserstoff, ist ein natürlich vorkommendes Isotop des Elements Wasserstoff. Es macht etwa 0,015% des gesamten Wasserstoffs auf der Erde aus. Deuterium kommt hauptsächlich in Form von Deuteriumoxid (D2O), auch bekannt als schweres Wasser, vor.
In den Ozeanen und Meeren ist Deuterium in einer geringen Konzentration gelöst, wobei die Verteilung relativ gleichmäßig ist. In der Atmosphäre kann man es ebenfalls nachweisen, jedoch in noch geringeren Mengen.
Berge und Gebirge spielen ebenfalls eine Rolle, da sie durch Gletscherwasser geringe Spuren dieses Isotops enthalten. Dies hängt mit dem natürlichen Wasserkreislauf zusammen, bei dem das Wasser ständig zwischen Meer, Land und Atmosphäre zirkuliert.
Pflanzen und Tiere besitzen ebenfalls Spuren von Deuterium, aufgenommen durch Trinkwasser und Nahrung. Diese winzigen Mengen sind für biologische Prozesse meist unerheblich, können aber in verschiedenen wissenschaftlichen Studien verwendet werden, um beispielsweise Stoffwechselwege zu verfolgen.
Zusammengefasst zeigt sich, dass Deuterium zwar nur in minimalen Anteilen vorkommt, seine Präsenz jedoch in vielen Bereichen, einschließlich Ozeanografie und Ökologie, von Interesse ist. Rohstoffe wie Erdöl oder Erdgas enthalten zudem geringe Mengen an Deuterium, was zu dessen Detektierung genutzt werden kann.
| Eigenschaften von Deuterium | Details |
|---|---|
| Atommasse | Ungefähr 2,014 u |
| Zahl der Neutronen | 1 |
| Häufigkeit auf der Erde | Etwa 0,015% des gesamten Wasserstoffs |
| Form in der Natur | Deuteriumoxid (D2O) oder schweres Wasser |
| Nutzung | Nukleartechnik, Spektroskopie, Tracer in biochemischen Untersuchungen |
Deuterium in der chemischen Bindung
In der chemischen Bindung spielt Deuterium eine besondere Rolle. Als Isotop des Wasserstoffs unterscheidet es sich durch ein zusätzliches Neutron im Atomkern. Diese Differenz führt zu einer höheren Masse und beeinflusst die physikalischen und chemischen Eigenschaften von Molekülen, in denen Deuterium anstelle von Protium (normaler Wasserstoff) vorkommt.
Ein markanter Unterschied ist die stärkere Bindungsenergie von deuterierten Verbindungen im Vergleich zu ihren protiumhaltigen Gegenstücken. Diese erhöhte Stabilität kann zu anderen Reaktionsgeschwindigkeiten und Mechanismen führen. Bei der Untersuchung von Reaktionsmechanismen wird oft der so genannte kinetische Isotopeneffekt genutzt, um genau diese Unterschiede zwischen Deuterium- und Wasserstoff-Verbindungen auszuwerten.
Ein weiterer wichtiger Aspekt ist die Verwendung von Deuterium zur sogenannten Deuterierung. Hierbei werden ausgewählte Wasserstoffatome in einem Molekül durch Deuterium ersetzt, was bei der strukturellen Analyse und Identifikation von Substanzen hilft. In der Forschung, insbesondere in der NMR-Spektroskopie, kommt die spezielle Bindungsnatur ebenfalls zum Tragen. Das Vorhandensein von Deuterium ändert das Magnetresonanzverhalten der Moleküle, wodurch Forscher wertvolle Informationen über deren Struktur gewinnen können.
Zusammengefasst lässt sich sagen, dass Deuterium aufgrund seiner einzigartige Eigenschaften eine wichtige Rolle in verschiedenen chemischen und wissenschaftlichen Anwendungen hat.
Video: Isotope
Video-Link: https://www.youtube.com/watch?v=0tKdDWpuZjY
Nutzung von Deuterium in der Nukleartechnik
In der Nukleartechnik findet Deuterium zahlreiche Anwendungen, wobei seine einzigartige Eigenschaft als schweres Wasserstoffisotop besonders nützlich ist. Eine bedeutende Nutzung von Deuterium liegt in seiner Funktion als Moderator in Kernreaktoren. Hier wird es verwendet, um die Geschwindigkeit der Neutronen zu verringern, was die Wahrscheinlichkeit erhöht, dass diese mit Uran-235 oder Plutonium-239 reagieren und somit eine Kettenreaktion auslösen.
Schweres Wasser, das chemisch als D2O bekannt ist und zwei Deuteriumatome enthält, spielt dabei eine Schlüsselrolle. Im Vergleich zu normalem Wasser (H2O) hat schweres Wasser eine höhere Fähigkeit, Neutronen zu verlangsamen, ohne sie stark abzuschwächen. Diese Eigenschaft macht Deuterium essenziell für bestimmte Typen von Reaktoren wie den CANDU-Reaktor, der auf der Verwendung von natürlichem Uran basiert.
Darüber hinaus kommt Deuterium in der Fusionsforschung zum Einsatz, wo es als Brennstoff infrage kommt. In experimentellen Anlagen wie dem ITER-Projekt wird versucht, durch die Verschmelzung von Deuterium und Tritium Energie zu gewinnen. Dieser Prozess zielt darauf ab, eine saubere und nahezu unerschöpfliche Energiequelle zu schaffen, die im Gegensatz zur Kernspaltung sicherer und umweltfreundlicher wäre.
Zusätzlich dient Deuterium auch in der Isotopentechnik. Es kann helfen, Materialprozesse zu analysieren und nachzuvollziehen, indem es spezifische Eigenschaften aufgrund seines hohen Massendifferentials im Vergleich zu gewöhnlichem Wasserstoff besitzt.
Die vielfältigen Anwendungsmöglichkeiten von Deuterium in der Nukleartechnik zeigen, welch wichtigen Beitrag dieses Element leistet. Seine speziellen physikalischen und chemischen Eigenschaften machen es unverzichtbar für fortgeschrittene Technologien und innovative Forschungsfelder.
Video: Schweres Wasser/Deuteriumoxid | TheScienceShow
Video-Link: https://www.youtube.com/watch?v=DJkgNHlZXEU
Rolle von Deuterium in der Spektroskopie
Deuterium spielt eine bedeutende Rolle in der Spektroskopie, insbesondere in der NMR-Spektroskopie (Kernspinresonanz). Dank seiner einzigartigen nuklearen Eigenschaften ist Deuterium ein wertvolles Tool für Forscher. Deuterium besitzt einen anderen Kernspin im Vergleich zu normalem Wasserstoff (Protium), was es ermöglicht, dass Deuterium-markierte Verbindungen detaillierte und spezifische Informationen über molekulare Strukturen liefern.
In der IR-Spektroskopie (Infrarotspektroskopie) wird Deuterium oft verwendet, um Vibrationsmodi von Molekülen zu analysieren. Die Masse von Deuterium ist doppelt so groß wie die von Protium, was zu niedrigeren Vibrationsfrequenzen führt. Diese Verschiebung ist entscheidend für das Verständnis von molekularer Dynamik und Strukturuntersuchungen.
Darüber hinaus verbessert Deuterierung häufig die Auflösung und Empfindlichkeit spektroskopischer Methoden. Bei der Untersuchung großer biologischer Moleküle kann Deuterium helfen, komplexe Ergebnisse klarer darzustellen. Dies gilt besonders für Proteine und Nukleinsäuren, bei denen Deuterium dazu beiträgt, konformationelle Änderungen und Interaktionen besser zu charakterisieren.
Zusammengefasst bietet Deuterium als stabiler Isotop zahlreiche Vorteile in der wissenschaftlichen Forschung und Technologieentwicklung. Seine Verwendung optimiert Analyseverfahren und liefert tiefere Einblicke in chemische Reaktionen und Prozesse.
Herstellung und Gewinnung von Deuterium
Die Herstellung und Gewinnung von Deuterium erfolgt hauptsächlich durch das Verfahren der Elektrolyse von Wasser. In diesem Prozess wird Wasser in seine Bestandteile Wasserstoff und Sauerstoff zerlegt, wobei der Anteil des Deuteriums im schwereren Wasserstoffmolekül (D2O) höher ist als im gewöhnlichen Wasser.
Ein weiteres Verfahren zur Gewinnung von Deuterium ist die Destillation von flüssigem Wasserstoff. Hierbei macht man sich den Unterschied in den Siedepunkten von normalem Wasserstoff (H2) und schwerem Wasserstoff (D2) zunutze. Aufgrund des höheren Siedepunktes von Deuterium kann es bei niedrigen Temperaturen abgetrennt werden.
In industriellem Maßstab wird Deuterium auch durch die Katalytische Austauschreaktion zwischen Methan und Schwerwasser oder durch Ammoniak-Hydrogen-Austauschverfahren gewonnen. Diese Methoden erfordern spezielle Anlagen und strenge Kontrolle der Prozessparameter, um eine hohe Reinheit des produzierten Deuteriums zu gewährleisten.
Eine weitere bekannte Methode ist der Thermosyphonalprozess, der jedoch weniger verbreitet ist. Dabei handelt es sich um einen kontinuierlichen Flüssig-Flüssig-Phasenaustausch zwischen einem Deuterium-haltigen Wasserstoffträger und normalem Wasserstoffgas.
Grundsätzlich ist die Gewinnung von reinem Deuterium kosten- und energieaufwendig. Daher liegt der wirtschaftliche Schwerpunkt oft auf der Extraktion von Deuteriumoxide (D2O), das wiederum für verschiedene industrielle Anwendungen weiterverwertet werden kann.
Durch diese vielfältigen Methoden können verschiedene Bedürfnisse gedeckt und spezifische Anforderungen erfüllt werden, wodurch Deuterium in verschiedenen Industrien effektiv nutzbar gemacht wird.
Gesundheits- und Umweltaspekte von Deuterium
Deuterium, auch bekannt als schwerer Wasserstoff, spielt eine wichtige Rolle in der Wissenschaft und Technik. Doch was bedeutet dies für die Gesundheit und Umwelt? Im Allgemeinen gilt Deuterium als nicht toxisch und daher ungefährlich bei geringen Konzentrationen.
Für den menschlichen Körper ist Deuterium in natürlichen Mengen völlig unbedenklich. Deuteriertes Wasser (D2O), auch ’schweres Wasser‘ genannt, enthält jedoch mehr Deuterium als normales Wasser und kann gesundheitliche Auswirkungen haben, wenn es in großen Mengen konsumiert wird. Dazu gehören Effekte wie eine Veränderung im Zellwachstum oder Stoffwechselprozesse. Solche Mengen sind allerdings unter normalen Umständen kaum erreichbar.
Ökologisch betrachtet führt natürlich vorkommendes Deuterium zu keinen bekannten negativen Auswirkungen auf die Umwelt. Bei industrieller Nutzung kann jedoch die Herstellung und Transport von Deuterium gewisse Risiken bergen. Besonders in der Nukleartechnik spielen Sicherheitsmaßnahmen eine entscheidende Rolle, um Unfälle zu vermeiden.
Zusammenfassend lässt sich sagen, dass Deuterium in seiner natürlichen Form meist unschädlich ist. Die industrielle Anwendung erfordert aber sorgfältige Handhabung, um negative Einflüsse auf Mensch und Natur zu minimieren.
Wirtschaftliche Bedeutung von Deuterium-industrie
Die wirtschaftliche Bedeutung der Deuterium-industrie geht weit über ihre Verwendung in der Nukleartechnik hinaus. Deuterium, auch als schwerer Wasserstoff bekannt, spielt eine kritische Rolle in verschiedenen Industriezweigen. Besonders hervorzuheben ist die Nutzung in der chemischen und pharmazeutischen Industrie.
In der Chemieforschung wird Deuterium verwendet, um Reaktionsmechanismen zu studieren. Mithilfe von Deuterium-markierten Verbindungen lassen sich wichtige Erkenntnisse gewinnen, die zur Entwicklung neuer Medikamente beitragen. Dies unterstreicht die Bedeutung dieses Elements für den Fortschritt in der medizinischen Forschung.
Ein weiterer wichtiger Aspekt ist die Verwendung von Deuterium in der Spektroskopie. Durch den Einsatz von Deuterium lassen sich genaue Analysen von Molekularstrukturen durchführen. Dies ist besonders wertvoll in Bereichen wie Materialwissenschaften und Umweltanalytik.
Auch in der Halbleiterindustrie findet Deuterium zunehmend Anwendung. Hier wird es genutzt, um die Haltbarkeit und Leistungsfähigkeit elektronischer Bauteile zu verbessern.
Nicht zuletzt hat Deuterium ökonomische Bedeutung im Bereich der Energiegewinnung. In zukünftigen Fusionsreaktoren könnte es als Brennstoff dienen und somit einen wichtigen Beitrag zur nachhaltigen Energieversorgung leisten.
Zusammengefasst zeigt sich, dass Deuterium in vielen technologischen und industriellen Anwendungen von großer Bedeutung ist.
Was gibt es noch für Isotope?
Hier sind einige Beispiele für Isotope von verschiedenen Elementen:
- Wasserstoff: Protium (H-1), Deuterium (H-2), Tritium (H-3)
- Kohlenstoff: C-12, C-13, C-14
- Uran: U-235, U-238
- Sauerstoff: O-16, O-17, O-18
- Neon: Ne-20, Ne-21, Ne-22
Jedes dieser Isotope hat eine unterschiedliche Anzahl von Neutronen im Atomkern, was zu unterschiedlichen Atomgewichten führt.