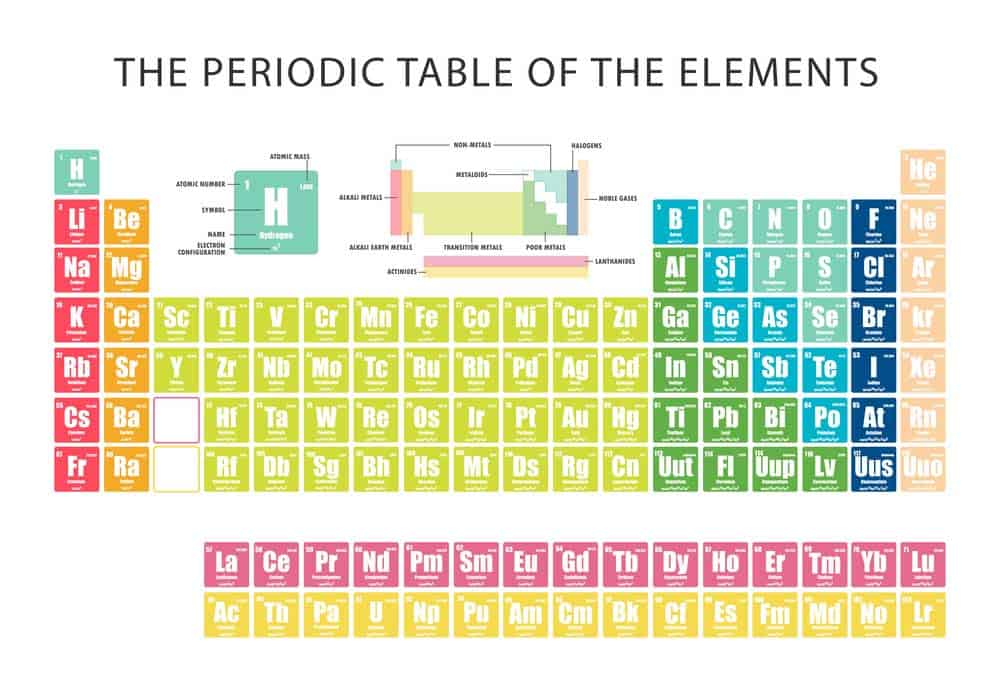
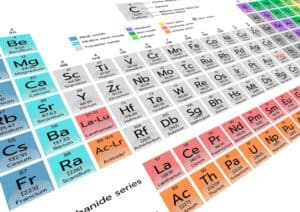
Das Periodensystem der Elemente ist ein unverzichtbares Werkzeug in den Naturwissenschaften. Es bietet eine systematische Anordnung der chemischen Elemente und stellt wichtige Informationen bereit, die für das Verständnis von chemischen Eigenschaften und Reaktionen notwendig sind. Doch was bedeuten eigentlich die verschiedenen Zahlen im Periodensystem und welche Informationen können daraus abgeleitet werden?
Die Ordnungszahl eines Elements gibt an, wie viele Protonen im Kern eines Atoms vorhanden sind, während die Massenzahl aus der Summe der Protonen und Neutronen resultiert. Bei näherer Betrachtung offenbart sich, dass weitere Nummern auch Auskunft über die Elektronenkonfiguration und Position innerhalb des Periodensystems liefern. Wesentlich sind ebenfalls die Gruppennummer, die Anzahl der Valenzelektronen beschreibt, und die Periodennummer, die Aufschluss über die Anzahl der Elektronenschalen liefert.
Zusätzlich wird oft die durchschnittliche Atommasse angegeben, was einen Überblick über die relative Masse der unterschiedlichen Isotope eines Elements ermöglicht. Anhand dieser grundlegenden Kennzahlen lässt sich ein umfassendes Verständnis der Eigenschaften und Verhaltensweisen von Elementen und deren Verbindungen erlangen.
Das Wichtigste in Kürze
- Die Ordnungszahl gibt die Anzahl der Protonen und bestimmt die Position im Periodensystem.
- Die Massenzahl ist die Summe der Protonen und Neutronen eines Atomkerns.
- Elektronenkonfiguration beschreibt, wie Elektronen auf verschiedenen Schalen verteilt sind.
- Die Gruppennummer entspricht der Anzahl der Valenzelektronen und beeinflusst chemisches Verhalten.
- Die Atommasse ist die durchschnittliche Masse der Atome eines Elements, basierend auf Isotopen.
Ordnungszahl: Anzahl der Protonen im Atomkern
Die Ordnungszahl spielt eine zentrale Rolle im Periodensystem der Elemente. Sie gibt die Anzahl der Protonen im Atomkern eines Elements an und bestimmt damit dessen Position im Periodensystem. Jedes Element hat eine eindeutige Ordnungszahl, die es von anderen Elementen unterscheidet.
Ein wesentliches Merkmal der Ordnungszahl ist, dass sie auch die Protonenzahl im Kern eines Atoms widerspiegelt. Da in einem neutralen Atom die Anzahl der Elektronen gleich der Anzahl der Protonen sein muss, sagt die Ordnungszahl ebenfalls aus, wie viele Elektronen sich um den Atomkern befinden.
Darüber hinaus definiert die Ordnungszahl die chemischen Eigenschaften des Elements. Dies liegt daran, dass sie die Anordnung der Elektronen bestimmt, insbesondere derjenigen Elektronen, die sich in der äußersten Schale befinden und für chemische Reaktionen verantwortlich sind.
Betrachten wir zum Beispiel das Element Wasserstoff mit der Ordnungszahl 1: Es besitzt einen einzigen Proton im Kern und ein Elektron in seiner Hülle. Ein anderes Beispiel wäre Sauerstoff mit der Ordnungszahl 8, was bedeutet, dass Sauerstoff acht Protonen im Kern hat.
Zusammengefasst bildet die Ordnungszahl die Grundlage dafür, wie Elemente im Periodensystem organisiert sind und welche einzigartigen Merkmale sie besitzen. Diese Zahl ist entscheidend für das Verständnis der gesamten Chemie jedes einzelnen Elements und deren mindestens ebenso vielfältigen Verbindungen.
Das Periodensystem der Elemente ist das umfassendste und mächtigste Werkzeug, das jedem Chemiker zur Verfügung steht, um die Eigenschaften der Materie zu verstehen. – Dmitri Iwanowitsch Mendelejew
| Begriff | Bedeutung |
|---|---|
| Ordnungszahl | Anzahl der Protonen im Atomkern |
| Massenzahl | Summe der Protonen und Neutronen |
| Elektronenkonfiguration | Verteilung der Elektronen in Schalen |
| Gruppennummer | Anzahl der Valenzelektronen |
| Periodennummer | Anzahl der Elektronenschalen |
| Atommasse | Durchschnittliche Masse der Atome eines Elements |
Massenzahl: Summe der Protonen und Neutronen
Der Begriff Massenzahl beschreibt die Summe der Protonen und Neutronen im Atomkern eines Elements. Beide Teilchenarten tragen zur Masse des Atoms bei, wodurch die Massenzahl einen wichtigen Hinweis auf das Gewicht des Atoms gibt.
Die Berechnung der Massenzahl ist einfach: Man addiert lediglich die Anzahl der Protonen und Neutronen im Kern seines Atoms. Dies unterscheidet sie von der Ordnungszahl, die nur die Anzahl der Protonen angibt.
Eine erhöhte Massenzahl weist auf eine größere Anzahl an Neutronen hin, was speziell bei Isotopen wichtig ist. Isotope sind Varianten desselben Elements mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl. Die Unterschiede in der Neutronenzahl können die physikalischen Eigenschaften der Isotope beeinflussen, wie etwa ihre Stabilität.
Wenn ein Element mehrere Isotope hat, wird häufig die durchschnittliche Atommasse verwendet. Diese berücksichtigt die Massen und Häufigkeiten der einzelnen Isotope. Dies führt zu einer präzisen Darstellung der tatsächlichen Masse, so wie sie in der Natur vorzufinden ist.
Kenntnisse über die Massenzahl sind grundlegend für das Verständnis der Struktur und Reaktivität der Elemente. Sie tragen entscheidend dazu bei, chemische Reaktionen vorherzusagen und neue Materialien zu entwickeln.
| Eigenschaft | Definition | Beispiel |
|---|---|---|
| Ordnungszahl | Anzahl der Protonen im Atomkern | Wasserstoff: 1 |
| Massenzahl | Summe der Protonen und Neutronen | Kohlenstoff: 12 |
| Elektronenkonfiguration | Verteilung der Elektronen in Schalen | Sauerstoff: 2-6 |
| Gruppennummer | Anzahl der Valenzelektronen | Natrium: 1 |
| Periodennummer | Anzahl der Elektronenschalen | Kalium: 4 |
| Atommasse | Durchschnittliche Masse der Atome eines Elements | Chlor: 35.5 |
Elektronenkonfiguration: Verteilung der Elektronen in Schalen
Die Elektronenkonfiguration eines Atoms beschreibt die Verteilung der Elektronen auf verschiedene Elektronenschalen um den Atomkern. Diese Verteilung folgt einem bestimmten Muster und hilft zu verstehen, wie ein Atom chemisch reagiert und welche Eigenschaften es hat.
Elektronenschalen sind Energieniveaus oder Bahnen, auf denen sich Elektronen bewegen. Sie werden von innen nach außen gezählt und mit den Buchstaben K, L, M, N usw. bezeichnet. Jedes Energieniveau kann nur eine begrenzte Anzahl an Elektronen aufnehmen: Die erste Schale (K) kann maximal 2 Elektronen haben, die zweite (L) bis zu 8 und so weiter.
Das Auffüllen der Elektronenschalen erfolgt nach dem Prinzip minimaler Energie. Das bedeutet, dass Elektronen zuerst die innersten, am niedrigsten gelegenen Schalen füllen, bevor sie in höhere Energieschalen wandern. Dies ist entscheidend für das chemische Verhalten eines Elements. Besonders wichtig ist hierbei die äußerste Schale, auch Valenzschale genannt.
Die Zahl der Elektronen in der Valenzschale bestimmt maßgeblich die chemischen Eigenschaften des Elements. Ein Beispiel: Wasserstoff hat nur ein Elektron und dieses befindet sich in der K-Schale. Sauerstoff hingegen hat 8 Elektronen: 2 in der K-Schale und 6 in der L-Schale.
Dieser Aufbau der Elektronenkonfiguration trägt dazu bei, die Stellung eines Elements im Periodensystem sowie seine Reaktivität vorherzusagen.
Gruppennummer: Anzahl der Valenzelektronen
Im Periodensystem steht die Gruppennummer für eine wichtige Eigenschaft der Elemente: die Anzahl der Valenzelektronen. Diese Elektronen befinden sich in der äußersten Schale eines Atoms und sind entscheidend für seine chemischen Eigenschaften.
Zum Beispiel haben alle Elemente in der ersten Hauptgruppe nur ein Valenzelektron, während alle Elemente der zweiten Hauptgruppe zwei Valenzelektronen besitzen. Dies erklärt, warum Elemente innerhalb derselben Gruppe oft ähnliche Reaktionen zeigen.
Die Zahl der Valenzelektronen nimmt von links nach rechts zu, sodass man anhand der Gruppennummer schnell erkennen kann, wie viele Elektronen im Äußeren des Atoms verfügbar sind. Dieses Wissen ist besonders nützlich, wenn es darum geht, chemische Bindungen und Reaktionsmuster vorherzusagen.
Außerdem helfen die Valenzelektronen dabei, die Tendenz eines Elements zur Bildung bestimmter Ionen oder kovalenter Verbindungen zu verstehen. Beispielsweise neigen Elemente mit sieben Valenzelektronen dazu, leicht ein zusätzliches Elektron aufzunehmen, um eine stabile Acht-Elektronen-Konfiguration zu erreichen.
Zusammengefasst ermöglicht die Gruppennummer einen genauen Einblick in die elektronischen Eigenschaften der Elemente und kann daher als eine Art „chemischer Fingerabdruck“ gesehen werden.
Video: Das Periodensystem – kurz und knapp
Video-Link: https://www.youtube.com/watch?v=MDtUUmkOBo4
Periodennummer: Anzahl der Elektronenschalen
Die Periodennummer in einem Periodensystem ist ein entscheidender Indikator für die Struktur eines Elements, da sie die Anzahl der Elektronenschalen angibt. Diese Schalen spielen eine wesentliche Rolle in der Chemie und Physik eines Elements.
Jede Periode im Periodensystem entspricht einer neuen, äußersten Elektronenschale, die von den Atomen belegt wird. Zum Beispiel hat Wasserstoff in der ersten Periode nur eine Elektronenschale, während Lithium in der zweiten Periode zwei Elektronenschalen besitzt. Dieses Muster setzt sich durch das gesamte Periodensystem fort.
Wenn man sich die Position eines Elements betrachtet, kann die Periodennummer wertvolle Informationen über die elektrischen Eigenschaften und Reaktivität des Elements liefern. Ein Element mit mehr Elektronenschalen weist in der Regel komplexere chemische und physikalische Eigenschaften auf.
Aus diesem Grund ist es hilfreich, die Periodennummer im Zusammenhang mit anderen Kennzahlen im Periodensystem zu verstehen. Dadurch lassen sich Vorhersagen über das Verhalten des Elements leichter treffen. Die Wechselwirkungen zwischen den Elektronenschalen beeinflussen auch, wie Elemente miteinander reagieren und Verbindungen bilden. Dies macht die Kenntnis der Periodennummer besonders wertvoll für Chemiker und Physiker.
Insgesamt bietet die Periodennummer nicht nur einen einfachen numerischen Wert, sondern stellt eine wichtige Grundlage dar, um das komplexe Zusammenspiel der verschiedenen atomaren Komponenten besser zu verstehen.
Atommasse: Durchschnittliche Masse der Atome eines Elements
Atommasse bezieht sich auf die durchschnittliche Masse der Atome eines Elements. Diese Masse wird in der Einheit „u“ (atomare Masseneinheit) gemessen und entspricht ungefähr der Summe der Massen von Protonen, Neutronen und Elektronen. Es ist jedoch wichtig zu beachten, dass die Elektronen eine sehr geringe Masse im Vergleich zu Protonen und Neutronen haben.
Atoms mas sen variieren aufgrund der Existenz verschiedener Isotope eines Elements. Jedes Isotop hat eine unterschiedliche Anzahl an Neutronen, während die Anzahl der Protonen gleich bleibt. Die Atommasse ergibt sich aus dem gewichteten Mittel der Massen dieser verschiedenen Isotope.
Ein weiterer interessanter Punkt ist, dass die Atommasse nicht einfach nur eine ganze Zahl ist, sondern oft als Dezimalzahl angegeben wird. Dies liegt daran, dass sie den durchschnittlichen Wert basiert auf der natürlichen Häufigkeit der Isotope darstellt.
Diese Information ist besonders nützlich für chemische Berechnungen und Experimente, da sie hilft, präzise Angaben zur Menge von Stoffmengen oder Reaktionsprodukten zu machen. Chemiker nutzen diese Zahlen auch, um Formeln zu bestimmen und das Verhalten von Substanzen unter verschiedenen Bedingungen vorherzusagen.
Das Wissen über die Atommasse eines Elements ermöglicht ein tieferes Verständnis seiner physikalischen und chemischen Eigenschaften, was wiederum zentrale Bedeutung für viele wissenschaftliche und industrielle Anwendungen hat.