Salznomenklatur
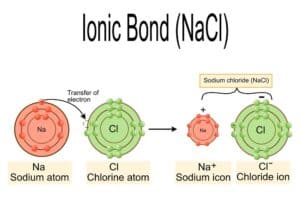
Salze sind chemische Verbindungen, die durch die Elektronenübertragung zwischen Atomen entstehen. Dabei werden positiv geladene Ionen (Kationen) und negativ geladene Ionen (Anionen) gebildet. Diese Ionen ziehen sich durch eine elektrostatische Anziehung gegenseitig an, wodurch ein kristallines Ionengitter entsteht. Dieses Gitter wird durch die sogenannte Gitterenergie stabilisiert, die frei wird, wenn sich die Kationen und Anionen zusammenlagern.
Die Nomenklatur der Salze folgt einem festgelegten Muster, bei dem der Name des Metallions oder des positiv geladenen Ions zuerst genannt wird, gefolgt vom Namen des negativ geladenen Ions mit der Endung „-id“. Zum Beispiel wird Natriumchlorid aus Natrium (Na+) und Chlorid (Cl-) gebildet. Daher lautet der Name des Salzes „Natriumchlorid“. Dieses System wird verwendet, um Salze eindeutig zu benennen und zu identifizieren.
Die Nomenklatur der Salze umfasst unterschiedliche Regelwerke und Konventionen, mit denen diese Verbindungen benannt werden können. Zentral ist dabei die Identifizierung der jeweiligen Ionen sowie deren Verhältnis im Salz. In vielen Fällen spielen zudem die Oxidationsstufe und der Ionenradius der beteiligten Elemente eine wichtige Rolle bei der Benennung. Eine klare und standardisierte Benennung hilft nicht nur in wissenschaftlichen Kontexten, sondern auch im alltäglichen Gebrauch, um Missverständnisse zu vermeiden.
Das Wichtigste in Kürze
- Salze entstehen durch die Elektronenübertragung, bilden Kationen und Anionen, die elektrostatisch gebunden sind.
- Nomenklatur der Salze: Erst Kation, dann Anion; binäre Salze aus Metall- und Nichtmetall-Ionen.
- Polyatomare Ionen wie Sulfat und Nitrat haben spezifische Namen und beeinflussen die Salzstruktur.
- Hydrate enthalten Kristallwasser, das durch griechische Präfixe im Namen angegeben wird.
- Unterschiedliche Benennungssysteme: IUPAC präzise, triviale Namen gängigen Gebrauch.
Die Nomenklatur der Salze bezieht sich auf die Benennung und Bezeichnung von Salzen in der Chemie. Salze werden nach einem festgelegten System benannt, das die Namen der beteiligten Ionen berücksichtigt. Dabei wird der Name des Metallions oder des positiv geladenen Ions vor dem des negativ geladenen Ions genannt. Diese Nomenklatur dient dazu, Salze eindeutig zu identifizieren und zu benennen. Das festgelegte System für die Nomenklatur der Salze wird als „IUPAC-Nomenklatur“ bezeichnet. IUPAC steht für „International Union of Pure and Applied Chemistry“ und ist die Organisation, die internationale Standards für die chemische Nomenklatur festlegt, einschließlich der Benennung von Salzen.
Grundbegriffe und Definitionen von Salzen
Salze sind chemische Verbindungen, die aus Ionen bestehen. Ionen sind geladene Teilchen, welche durch die Abgabe oder Aufnahme von Elektronen entstehen. Dabei handelt es sich um eine Elektronenübertragung, bei der Kationen und Anionen gebildet werden.
Es bedeutet, dass ein Atom Elektronen abgibt und dadurch positiv geladen wird. Dagegen entsteht bei der ein negativ geladenes Ion durch die Aufnahme von Elektronen. Diese entgegengesetzt geladenen Ionen ziehen sich aufgrund der elektrostatischen Anziehung an und bilden ein stabiles Salzgitter.
In einem Salz sind die Ionen regelmäßig in einer Kristallstruktur angeordnet. Dies führt zu einer charakteristischen Ionenanordnung, weshalb Salze oft kristallin und fest sind. Die Stabilität solcher Strukturen hängt stark von der <Bindungsstärke> zwischen den Ionen ab. Die Bildung eines gut geordneten Gitters setzt Energie frei, was als bezeichnet wird.
Die beim Gitteraufbau freigesetzte Energie nennt man . Sie ist ein wichtiger Indikator für die Stabilität eines Salzes. Faktoren wie der und die der beteiligten Ionen spielen dabei eine wesentliche Rolle. Beispielsweise beeinflusst der Ionenradius die elektrostatische Kraft: kleinere Ionen ziehen sich stärker an, was meist zu einer höheren Gitterenergie führt.
Das Wesen der chemischen Bindung und der Strukturen, die sie hervorbringen, ist für das Verständnis der Materie grundlegend. – Linus Pauling
| Begriff | Definition |
|---|---|
| Elektronenübertragung | Beim chemischen Prozess, bei dem Elektronen von einem Atom zu einem anderen übertragen werden, entstehen Ionen. |
| Kation Bildung | Ein Prozess, bei dem ein Atom Elektronen abgibt und dadurch zu einem positiv geladenen Ion wird. |
| Anion Bildung | Ein Prozess, bei dem ein Atom Elektronen aufnimmt und dadurch zu einem negativ geladenen Ion wird. |
| Elektrostatische Anziehung | Die Anziehungskraft zwischen positiv und negativ geladenen Ionen. |
| Ionenanordnung | Die regelmäßige, kristalline Struktur, in der Ionen in einem Salz angeordnet sind. |
| Bindungsstärke | Ein Maß für die Stärke der Anziehungskräfte zwischen Kationen und Anionen in einem Salz. |
| Exothermer Prozess | Ein Prozess, bei dem Energie freigesetzt wird, zum Beispiel bei der Bildung eines Iongitters. |
| Gitterenergie | Die Energie, die bei der Bildung eines kristallinen Iongitters freigesetzt wird. |
| Ionenradius | Der Radius eines Ions, der die Größe des Ions beschreibt und die Stärke der elektrostatischen Anziehung beeinflusst. |
| Oxidationsstufe | Eine Zahl, die die Anzahl der Elektronen angibt, die ein Atom in einem Molekül oder Ion abgegeben oder aufgenommen hat. |
Kationen und Anionen in Salznamen
In der Nomenklatur der Salze spielen sowohl Kationen als auch Anionen eine entscheidende Rolle. Ein Kation ist ein positiv geladenes Ion, das durch Elektronenübertragung von einem Atom oder Molekül hin zu einem anderen entsteht. Dieser Prozess wird allgemein als Kation Bildung bezeichnet.
Auf der anderen Seite steht das Anion, ein negativ geladenes Ion, das Elektronen aufnimmt. Diese Aufnahme von Elektronen wird Anion Bildung genannt. Beide Ionen verbinden sich aufgrund ihrer entgegengesetzten Ladungen durch elektrostatische Anziehung und bilden so die Basis eines Salzes.
Die Reihenfolge bei der Benennung eines Salzes ist klassisch: zuerst das Kation, gefolgt vom Anion. Zum Beispiel besteht Natriumchlorid aus Natrium-Kationen (Na⁺) und Chlorid-Anionen (Cl⁻). Die chemische Formel zeigt deutlich die Art der Ionenanordnung und hilft dabei, die Bindungsstärke zwischen den Ionen zu verstehen.
Dieser exotherme Prozess der Salzbildung trägt zur Stabilität des Systems bei, indem Gitterenergie freigesetzt wird – ein Maß für die Energie, die nötig wäre, um die ionischen Verbindungen im festen Zustand zu trennen. Die Gitterenergie hängt stark vom Ionenradius und der Oxidationsstufe der beteiligten Ionen ab.
Nomenklatur binärer Salze
Die Nomenklatur binärer Salze ist ein grundlegender Aspekt der Chemie, wobei binäre Salze aus zwei Elementen bestehen: einem Metall und einem Nichtmetall.
Im Namen eines binären Salzes wird das Kation (positiv geladenes Ion) zuerst genannt, gefolgt vom Anion (negativ geladenes Ion). Ein klassisches Beispiel hierfür ist Natriumchlorid (NaCl), wo „Natrium“ das Kation und „Chlorid“ das Anion ist.
Das Kation entsteht durch Elektronenübertragung vom Metall zum Nichtmetall, was als Kation Bildung bezeichnet wird. Das resultierende positiv geladene Ion (Kation) zieht das negativ geladene Ion (Anion) durch elektrostatische Anziehung an. Diese Ionenanordnung bildet die stabile Struktur des Salzes.
Ein weiterer Schritt ist die Benennung des Anions. Hierzu wird der Name des Elements verwendet und die Endung „-id“ hinzugefügt. So wird aus Chlor das Anion Chlorid und aus Schwefel Sulfid.
Bei Metallen, die unterschiedliche Oxidationsstufen haben können, wird die spezifische Oxidationszahl des Metalls in römischen Zahlen angegeben. Ein Beispiel dafür ist Eisen(II)-chlorid (FeCl2) im Vergleich zu Eisen(III)-chlorid (FeCl3).
Durch diese systematische Nomenklatur kann man die chemische Zusammensetzung und somit auch bestimmte Eigenschaften, wie Bindungsstärke und<Ionenradius, herleiten. Dies trägt dazu bei, das Verständnis für exotherme Prozesse und deren Gitterenergie zu vertiefen.
Polyatomare Ionen und ihre Benennung
Polyatomare Ionen bestehen aus mehreren Atomen, die gemeinsam eine Ladung tragen. Diese Ionen spielen eine wichtige Rolle bei der Bildung vieler Salze und haben spezifische Namen je nach ihrer Zusammensetzung. Häufige polyatomare Ionen sind das Carbonat-Ion (CO₃²⁻), das Sulfat-Ion (SO₄²⁻) und das Nitrat-Ion (NO₃⁻).
Polyatomare Ionen werden ähnlich wie einatomige Ionen benannt, wobei der Unterschied darin besteht, dass ihre Namen oft auf die Art der enthaltenen Elemente sowie deren Anzahl hinweisen. Wenn beispielsweise Wasserstoff in einem Polyatomaren Ion vorkommt, wird dies durch ein Präfix wie „Hydrogen“ oder „Dihydrogen“ angegeben.
In den Namen von Salzen, die polyatomare Ionen enthalten, steht der Name des Kations zuerst, gefolgt vom Namen des Anions. Ein Beispiel hierfür ist Calciumcarbonat (CaCO₃), bei dem „Calcium“ für das Ca²⁺-Ion und „Carbonat“ für das CO₃²⁻-Ion steht.
Wichtig ist auch die Kenntnis der Oxidationsstufen beim Benennen dieser Ionen, vor allem wenn sie verschiedene Varianten besitzen. So gibt es neben dem Sulfat-Ion (SO₄²⁻) auch das Sulfit-Ion (SO₃²⁻), wobei der Unterschied in der Anzahl der Sauerstoffatome klar wird.
Diese Ionen sind aufgrund ihrer spezifischen Strukturen und Eigenschaften elementar für die Chemie. Sie beeinflussen Faktoren wie Gitterenergie, Bindungsstärke und die allgemeine Stabilität des durch sie gebildeten Salzes. Indem man sich mit den Namen dieser Ionen vertraut macht, erhält man ein tieferes Verständnis für chemische Gleichgewichte und Reaktionsmechanismen.
Hydrate und ihre spezifischen Namen
Einige Salze können Kristallwasser enthalten, was zu Hydraten führt. Diese spezifischen Namen sind wichtig, um die genaue Zusammensetzung des Salzes zu verstehen. Ein häufiges Beispiel ist Kupfersulfat, das oft als Kupfersulfat-Pentahydrat (CuSO4·5H2O) vorliegt.
Die Anzahl der Wassermoleküle wird durch griechische Zahlwörter angegeben: Mono-, Di-, Tri-, Tetra- usw. Bei Kupfersulfat-Pentahydrat bedeutet dies, dass fünf Wassermoleküle pro Formeleinheit vorhanden sind. Dies sollte immer in der chemischen Form und im Namen des Salzes dargestellt werden.
Hydrate entstehen typischerweise, wenn Ionen in Wasser gelöst und anschließend kristallisiert werden. Die elektrostatische Anziehung zwischen dem Salz und den Wassermolekülen führt zur Bildung von Hydraten. Zum Beispiel bindet das Kaliumaluminiumsulfat zwölf Moleküle Wasser und wird dann als Alaun (KAl(SO4)2·12H2O) bezeichnet.
Beim Erhitzen verlieren viele Hydrate ihr Kristallwasser und gehen in ihre wasserfreie Form über. Dieser Prozess kann reversibel sein, was bedeutet, dass sie wieder hydratisiert werden können, wenn sie erneut mit Wasser in Kontakt kommen.
Zusammengefasst ist die Benennung von Hydraten eine präzise Methode, um die zusätzliche Wassermenge innerhalb eines Kristalls anzuzeigen. Dies ist ein wichtiger Aspekt in vielen Bereichen der Chemie, da das Vorhandensein von Kristallwasser die physikalischen und chemischen Eigenschaften des Salzes beeinflussen kann.
| Ion | Symbol | Beispiele für Salze |
|---|---|---|
| Sulfat | SO₄²⁻ | Calciumsulfat (CaSO₄), Gips (CaSO₄·2H₂O) |
| Nitrat | NO₃⁻ | Kaliumnitrat (KNO₃), Ammoniumnitrat (NH₄NO₃) |
| Carbonat | CO₃²⁻ | Calciumcarbonat (CaCO₃), Natriumcarbonat (Na₂CO₃) |
| Phosphat | PO₄³⁻ | Calciumphosphat (Ca₃(PO₄)₂), Natriumphosphat (Na₃PO₄) |
| Ammonium | NH₄⁺ | Ammoniumchlorid (NH₄Cl), Ammoniumsulfat ((NH₄)₂SO₄) |
Regeln und Ausnahmen bei der Benennung
Bei der Benennung von Salzen gibt es bestimmte Regeln, die die systematische Bezeichnung erleichtern. Eine grundlegende Regel ist, zuerst das Kation und dann das Anion zu benennen. Beispielsweise wird NaCl als Natriumchlorid bezeichnet.
Eine wichtige Regel ist die Anwendung der Oxidationsstufe des Metalls im Namen. Bei Übergangsmetallen, die mehrere Oxidationszustände haben können, zeigt man diese mit römischen Ziffern in Klammern an. Ein Beispiel hierfür ist FeCl₂, das als Eisen(II)-chlorid bezeichnet wird, während FeCl₃ Eisen(III)-chlorid heißt.
Es gibt auch Ausnahmen von diesen Regeln, insbesondere bei traditionellen Namen. Zum Beispiel wird Calciumoxid immer noch als gebrannter Kalk bekannt. Im Fall polyatomarer Ionen behalten viele traditionelle Verbindungen wie Ammoniumnitrat (NH₄NO₃) ihre historisch etablierten Namen.
Weiters, bei Hydraten, zeigen wir die Anzahl der Wassermoleküle durch einen griechischen Zahlenpräfix an und fügen „-hydrat“ hinzu. So wird CuSO₄·5H₂O als Kupfersulfat-Pentahydrat bezeichnet.
Ein wesentliches Merkmal bei der Benennung von Säuren und deren entsprechenden Salzen stellt sicher, dass je nach dem Ursprung der Säure verschiedene Endungen verwendet werden – Salze von Chlorwasserstoffsäure enden auf ‚-id‘ (z.B., Cl⁻ wird zu Chlorid), während Salze von Schwefelsäure Wechsel zwischen ‚-at‘ und ‚-it‘ basierend auf ihrem Oxidationszustand erfahren (z.B., SO₄²⁻ wird zu Sulfat und SO₃²⁻ zu Sulfit).
Praktische Beispiele und Anwendungen
Salze finden sich in vielen Bereichen des Alltags und der industriellen Anwendungen. Ein bekanntes Beispiel ist Natriumchlorid (Kochsalz), das in der Küche verwendet wird. Natriumchlorid besteht aus den Ionen Na+ und Cl–. Die Bildung dieses Salzes erfolgt durch die Elektronenübertragung von Natrium zu Chlor, wodurch ein Kation und ein Anion entstehen. Dies führt zur elektrostatischen Anziehung zwischen den entgegengesetzt geladenen Ionen.
Ein weiteres Beispiel ist Calciumcarbonat (CaCO3), das als Hauptbestandteil in Kalkstein, Marmor und Kreide vorkommt. Calciumcarbonat bildet stabile Gitterstrukturen aufgrund seiner hohen Gitterenergie, die durch die starke elektrostatische Anziehung der Ca2+ und CO32- Ionen bestimmt wird.
In der Medizin spielt Kaliumpermanganat (KMnO4) eine Rolle als Desinfektionsmittel. Dieses Salz hat stark oxidierende Eigenschaften, die auf die verschiedenen Oxidationsstufen von Mangan zurückzuführen sind. Solche Eigenschaft wird durch die Bindungsstärke und die spezifischen Redox-Potentiale der beteiligten Ionen ermöglicht.
Zusätzlich gibt es Hydrate wie Copper(II)-Sulfat-Pentahydrat (CuSO4·5H2O), welche blaue Kristalle bilden. Das Hydra-ionisierungsverfahren bewirkt dabei die Aufnahme von Wasser in die Ionenanordnung des festen Salzes. Der Ionenradius und die exothermen Prozesse während der Hydration beeinflussen entscheidend die Struktur und Stabilität dieser Verbindungen.
Dies sind nur einige Beispiele für die vielseitigen Anwendungen von Salzen in verschiedenen Bereichen und verdeutlichen die Vielfalt und Wichtigkeit der ionischen Verbindungen in unserem täglichen Leben.
Unterschiedliche Benennungen internationale Systeme
Während die Nomenklatur von Salzen in der Chemie weltweit anerkannt ist, gibt es mehrere internationale Systeme für deren Benennung. Diese können sich je nach Region oder wissenschaftlicher Tradition unterscheiden.
Ein gängiges System ist das der Internationalen Union für Reine und Angewandte Chemie (IUPAC). Die IUPAC-Richtlinien legen fest, dass die Namen von Salzen aus den Bezeichnungen der Kationen und Anionen bestehen, wobei die Oxidationsstufe des Metalls im Falle mehrerer möglicher Oxidationszustände angegeben wird. Zum Beispiel heißt FeCl2 Eisen(II)-chlorid, während FeCl3 als Eisen(III)-chlorid bezeichnet wird.
Ein weiteres verbreitetes System ist das traditionelle oder triviale Benennungssystem. In diesem System werden oft gebräuchlichere Namen verwendet. So wird NaCl nicht als Natriumchlorid, sondern einfach als Kochsalz bezeichnet. Dieses System kann besonders bei allgemeineren chemischen Prozessen anwendungsfreundlich sein, da es weniger spezifisch ist und dennoch verständliche Bezeichnungen liefert.
Der Unterschied zwischen diesen Systemen liegt oft darin, wie präzise sie sind. Während die IUPAC-Nomenklatur sehr genau und formell ist, neigen triviale Namen dazu, alltäglicher und einfacher zu sein.
Elektrostatische Anziehung und Ionenanordnung sind zentrale Konzepte, unabhängig davon, welches Benennungssystem angewendet wird. Sie beschreiben die grundlegenden Kräfte und Strukturen, die zur Bildung von Salzen führen.
Diese verschiedenen Ansätze ermöglichen eine flexible Anwendung der chemischen Nomenklatur in unterschiedlichen Kontexten, wodurch Missverständnisse minimiert werden.