Bestandteile von Salzen
Salze bestehen aus positiv geladenen Kationen und negativ geladenen Anionen. Diese Ionen werden durch elektrische Anziehungskräfte zusammengehalten. Meistens sind Kationen Metallionen und Anionen Nichtmetallionen, welche die Struktur von Salzen formen. Typischerweise haben viele Salze eine Kristallgitterstruktur.
Ein bekanntes Beispiel für ein Salz ist Natriumchlorid (NaCl). Die Wasserlöslichkeit von Salzen variiert je nach deren Zusammensetzung erheblich. In der Chemie spielen Salze eine wichtige Rolle in verschiedenen biochemischen Prozessen.
Das Wichtigste in Kürze
- Salze bestehen aus positiven Kationen und negativen Anionen, die durch elektrische Anziehung zusammengehalten werden.
- Ein bekanntes Beispiel für ein Salz ist Natriumchlorid (NaCl), auch als Kochsalz bekannt.
- Die Kristallgitterstruktur ist typisch für viele Salze und erklärt deren physikalische Eigenschaften.
- Die Wasserlöslichkeit von Salzen variiert je nach deren chemischer Zusammensetzung erheblich.
- Salze spielen eine entscheidende Rolle in biochemischen Prozessen und zahlreichen physiologischen Funktionen.
Salze in der Chemie bestehen aus positiv geladenen Metallionen und negativ geladenen Nichtmetallionen. Diese Ionen bilden eine stabile Verbindung, indem sie sich in einer regelmäßigen Kristallstruktur anordnen. Die positiven und negativen Ladungen der Ionen ziehen sich an und bilden zusammen das Salz.
Salze bestehen aus positiv geladenen Kationen
Salze bestehen aus positiv geladenen Kationen. Diese Kationen sind Atom- oder Molekülgruppen, die eine positive elektrische Ladung tragen. Die Bildung dieser positiven Ladung erfolgt durch den Verlust von Elektronen. Die Anzahl der verlorenen Elektronen bestimmt die Höhe der positiven Ladung, die das Ion trägt.
Ein bekanntes Beispiel für ein Kation ist das Natriumion (Na+). Es entsteht, wenn ein Natriumatom ein Elektron abgibt und somit eine positive Ladung erhält. Andere häufig vorkommende Kationen umfassen Kaliumionen (K+), Kalziumionen (Ca2+), und Magnesiumionen (Mg2+).
Die Kationen spielen eine wichtige Rolle in der Struktur und den Eigenschaften von Salzen. Sie interagieren mit negativ geladenen Anionen, um stabile Verbindungen zu bilden. Diese Bindungen entstehen als Ergebnis der starken elektrostatischen Anziehungskräfte zwischen den entgegengesetzt geladenen Ionen.
Die Kombination solcher Ionen führt zur Bildung gut organisierter Kristallstrukturen. Diese Strukturen sind in vielen Fällen charakteristisch für die physikalischen Eigenschaften von Salzen, wie etwa ihre Härte und Sprödigkeit. Außerdem beeinflussen sie auch die Löslichkeit der Salze in Wasser.
Wenn es um Salze geht, gehören Wissen und Verständnis über die beteiligten Kationen zu den fundamentalen Aspekten, die zum allgemeinen Chemieverständnis beitragen.
Chemie ist nicht nur das Studium einzelner Stoffe, sondern vor allem der Verbindungen und Reaktionen zwischen ihnen. – Justus Liebig
| Kation | Beispiel |
|---|---|
| Natriumion | Na+ |
| Kaliumion | K+ |
| Kalziumion | Ca2+ |
| Magnesiumion | Mg2+ |
Negativ geladene Anionen sind ebenfalls enthalten
Negativ geladene Anionen sind ebenfalls enthalten in Salzstrukturen. Diese Anionen ergänzen die Zusammensetzung der Salze und sorgen gemeinsam mit den Kationen für ihre elektrische Neutralität.
Ein häufiger Typ von Anion ist das Chlorid-Ion (Cl–), welches im bekannten Natriumchlorid (NaCl) vorkommt. In diesem Salz liegt das Natrium als positiv geladenes Ion (Na+) vor, während das Chlorid-Ion als negativ geladenes Anion fungiert. Diese Wechselwirkung zwischen den entgegengesetzt geladenen Ionen bildet das stabile Kristallgitter, das typisch für viele Salze ist.
Die Rolle der negativen Anionen geht jedoch weit über das einfache Funktionieren von Kochsalz hinaus. Verschiedene Anionen wie Sulfat (SO42-), Nitrat (NO3–) oder Carbonat (CO32-) kombinieren sich mit unterschiedlichen Metallkationen, um eine Vielzahl an Salzen zu bilden, die verschiedene chemische Eigenschaften aufweisen.
Diese Eigenschaften beeinflussen unter anderem die Wasserlöslichkeit der Salze, was ein wesentlicher Faktor bei ihrer Verwendung in biochemischen Prozessen und industriellen Anwendungen ist. Einige Salze lösen sich leicht in Wasser auf und spielen so eine wichtige Rolle bei vielen biologischen Funktionen, während andere schwerer löslich sind und daher ganz andere Einsatzbereiche finden.
Es wird deutlich, dass der Aufbau und die Struktur von Salzen vielfältig und komplex sein können. Die korrekte Kombination von Anionen und Kationen sowie ihre Wechselwirkungen sind entscheidend für die Eigenschaften und Verwendungen dieser wichtigen Stoffklasse.
Elektrische Anziehung hält diese Ionen zusammen
Salze bestehen sowohl aus positiv geladenen Kationen als auch aus negativ geladenen Anionen. Diese Ionen werden durch die elektrische Anziehung zusammengehalten, die zwischen den entgegengesetzt geladenen Teilchen wirkt. Daraus ergibt sich eine feste und stabile Struktur.
Wenn man sich fragt: „Wie sind Salze aufgebaut?“, sollte man verstehen, dass diese elektrische Anziehungskraft ein essenzieller Bestandteil ihrer Bildung ist. Ohne diese würden die Kationen und Anionen nicht in der Lage sein, eine stabile Verbindung zu bilden.
Salze entstehen häufig aus Metallionen (Kationen) und Nichtmetallionen (Anionen). Ein klassisches Beispiel dafür ist Natriumchlorid (NaCl), besser bekannt als Speisesalz, bei dem Natrium- und Chlorid-Ionen eine starke ionische Bindung eingehen, um das Kristallgitter zu formen.
Die positive und negative Ladung dieser Ionen ermöglicht es ihnen, sich in einer regelmäßigen, wiederholenden Reihenfolge anzuordnen, was zur charakteristischen Kristallstruktur vieler Salze führt. Diese Struktur verleiht den Salzen ihre hohe Schmelz- und Siedepunkte sowie ihre Härte.
Neben physikalischen Eigenschaften hat die elektrische Anziehungskraft auch Einfluss auf die Löslichkeit von Salzen in Wasser. Beim Auflösen in Wasser brechen die ionischen Verbindungen auf und die Ionen hydratisieren, indem sie sich mit Wassermolekülen umgeben. Dies erklärt, warum einige Salze sehr gut wasserlöslich sind, während andere dies weniger oder gar nicht sind.
Video: Ionen, Salzbildung u. Verhältnisformel – in Ruhe erklärt
Video-Link: https://www.youtube.com/watch?v=SAPKksJqVAk
Metallionen und Nichtmetallionen bilden die Salze
Metallionen und Nichtmetallionen sind entscheidend für die Bildung von Salzen. Wenn sich eine positive Metallion mit einer negativen Nichtmetallion verbindet, entsteht ein Salz. Diese Wechselwirkung beruht auf der elektrischen Anziehung zwischen den entgegengesetzt geladenen Ionen, die sie zusammenhält.
Salze wie Natriumchlorid (NaCl), auch bekannt als Speisesalz, verdeutlichen dieses Prinzip gut. Hierbei handelt es sich um eine Verbindung von Natriumionen (Na+) und Chloridionen (Cl–). Diese Zusammenlagerung führt zur Ausbildung eines stabilen Kristallgitters, typisch für viele Salze.
In chemischer Hinsicht tragen diese verschiedenen Ionen zur Stabilität des kristallinen Festkörpers bei. Die Kationen und Anionen sind räumlich so angeordnet, dass sich ihre Ladungen ausgleichen, was zu einem elektrisch neutralen Feststoff führt. Diese Struktur lässt sich in der Kombination von anderen Metallen und Nichtmetallen ebenfalls beobachten, was zeigt, wie vielseitig das Konzept von Salzen ist.
Besonders bedeutsam ist, dass sich nicht alle Salze gleich verhalten. Beispielsweise variiert die Wasserlöslichkeit von Salzen, abhängig von ihren spezifischen Zusammensetzungen. Einigen Salzen ermöglicht diese Eigenschaft, in biochemischen Prozessen wesentliche Rollen einzunehmen, wie etwa in Zellfunktionen oder Stoffwechselvorgängen.
Zusammengefasst lassen sich also sagen, dass Salze durch die Interaktion von Metall- und Nichtmetallionen entstehen, wobei die positive Metallion die negative Nichtmetallion anzieht und somit stabile Strukturen bildet.
Kristallgitterstruktur typisch für viele Salze
Viele Salze weisen eine typische Kristallgitterstruktur auf. Diese Struktur entsteht, weil die Kationen und Anionen in einem regelmäßigen, dreidimensionalen Muster angeordnet sind. Die Gitterstruktur sorgt für die Stabilität des Salzes und erklärt viele seiner physikalischen Eigenschaften, wie etwa den hohen Schmelzpunkt.
Die Anordnung der Ionen in einem Kristallgitter erfolgt nach dem Prinzip der minimalen Energie: Es gibt eine optimale Balance zwischen der Anziehungskraft der entgegengesetzt geladenen Ionen und der Abstoßung gleicher Ladungen. Dadurch ist das Gitter energetisch besonders stabil.
Ein bekanntes Beispiel für ein Salz mit einer ausgeprägten Kristallstruktur ist Natriumchlorid (NaCl). In diesem Fall bildet jede Natrium-Ion (Na⁺) Paare mit Chlorid-Ionen (Cl⁻), welche in einer kubischen Formation aufgereiht sind.
Diese Kristalldarstellung hat nicht nur theoretische Bedeutung, sondern beeinflusst auch praktische Anwendungen. Sie spielt eine Rolle bei der Berechnung von Solubilitäten und der Entwicklung neuer Materialien. Zudem tragen Kristallgitter zur Härte vieler Salze bei und bewirken, dass sie sich in charakteristischen kubischen Formationen brechen lassen.
In Bezug auf die Frage „Wie sind Salze aufgebaut?“ ist die Kristallgitterstruktur ein zentrales Merkmal, das nicht nur die Ordnung der Moleküle beschreibt, sondern auch Aufschluss über ihre chemischen und physikalischen Eigenschaften gibt.
| Anion | Ion | Verwendung |
|---|---|---|
| Chlorid | Cl– | Kochsalz (NaCl) |
| Sulfat | SO42- | Gips (CaSO4) |
| Nitrat | NO3– | Düngemittel |
| Carbonat | CO32- | Kreide (CaCO3) |
NaCl ist bekanntes Beispiel für Salz
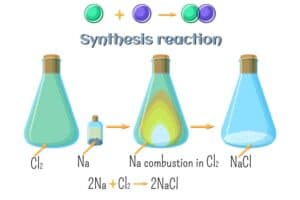
Ein bekanntes Beispiel für ein Salz ist Natriumchlorid (NaCl). Natriumchlorid besteht aus Natriumionen (Na+) und Chloridionen (Cl–). Diese Ionen werden durch eine starke elektrostatische Anziehungskraft, auch als ionische Bindung bekannt, zusammengehalten. In seiner kristallinen Form ordnen sich die Ionen in einem regelmäßigen, dreidimensionalen Gitter an.
Die chemische Reaktion zur Bildung von NaCl kann wie folgt beschrieben werden:
2 Na (Metall) + Cl2 (Gas) → 2 NaCl (Salz)
Natriumchlorid ist besonders bekannt, weil es das gewöhnliche Kochsalz darstellt, welches wir täglich in unserer Ernährung verwenden. Dieses Salz spielt nicht nur in der Küche eine wesentliche Rolle, sondern auch in vielen industriellen Prozessen, wie z.B. bei der Herstellung von Chemikalien oder für die Wasseraufbereitung.
Doch NaCl ist mehr als nur Würze – es hat zum Beispiel wichtige Funktionen im menschlichen Körper. Es trägt zur Regulation des Flüssigkeitshaushalts bei und ist notwendig für die Funktion von Nerven und Muskeln. Die Wasserlöslichkeit von NaCl ermöglicht seine einfache Verfügbarkeit und Aufnahme im Körper.
Ein weiterer interessanter Aspekt von Salzen wie NaCl ist ihre Eigenschaft, bei Auflösung in Wasser elektrisch leitfähig zu sein. Dies liegt daran, dass die gelösten Ionen im Wasser frei beweglich sind und somit elektrische Ströme leiten können.
Wasserlöslichkeit variiert je nach Salztyp
Die Wasserlöslichkeit von Salzen kann stark variieren je nach der Art des Salzes. Einige Salze, wie Kochsalz (Natriumchlorid), lösen sich sehr gut in Wasser, während andere, wie Kalziumsulfat, nur wenig löslich sind.
Löslichkeit hängt hauptsächlich von den Eigenschaften der Ionen ab, aus denen das Salz besteht. Kationen und Anionen mit hoher elektrischer Ladung neigen dazu, weniger löslich zu sein, da die ionischen Bindungen in diesem Fall stärker sind.
Es gibt mehrere Faktoren, die diese Löslichkeit beeinflussen. Einer der wichtigsten ist die Größe der Ionen. Größere Ionen erzeugen oft eine schwächere elektrische Anziehungskraft zwischen den Teilchen, was die Löslichkeit erhöht. Auch die Temperatur des Wassers spielt eine Rolle: Bei höherer Temperatur können viele Salze besser gelöst werden.
Entscheidend ist ebenfalls die Polarität des Lösungsmittels. Da Wasser ein polares Molekül ist, löst es bevorzugt polare Substanzen wie viele Salze. Unpolare Salze hingegen lösen sich schlecht in Wasser.
Zusammengefasst ist die Löslichkeit von Salzen kein einheitlicher Wert, sondern variiert stark abhängig von den spezifischen chemischen Eigenschaften des jeweiligen Salzes und den Bedingungen ihrer Umgebung.
Salze spielen große Rolle in biochemischen Prozessen
Salze spielen eine große Rolle in biochemischen Prozessen und sind für viele lebenswichtige Funktionen unerlässlich. Ionen, die aus Salzen entstehen, sind entscheidend für die Aufrechterhaltung der Zellspannung sowie den Transport von Nährstoffen und Abfallstoffen durch die Zellmembranen. Beispielsweise ist Natriumchlorid (NaCl) essenziell für das Gleichgewicht zwischen Wasser und Elektrolyten im Körper.
Der Transport von Nervensignalen beruht ebenfalls auf dem Austausch von Ionen wie Natrium und Kalium, was bedeutet, dass diese Salze eine zentrale Rolle im Nervensystem spielen. Ein Ungleichgewicht dieser Ionen kann zu ernsthaften gesundheitlichen Problemen führen, einschließlich einer gestörten Nervenfunktion oder Muskelschwäche.
Darüber hinaus helfen Salze bei der Regulierung des Blutdrucks und des pH-Werts im Körper, indem sie spezifische Pufferlösungen bilden, die extreme Schwankungen verhindern. Dies zeigt, wie wichtig der richtige Salzgehalt im Blut und anderen Körperflüssigkeiten ist.
Nicht nur beim Menschen, sondern auch bei Pflanzen sind Salze wichtig. Sie tragen zur osmotischen Regulierung bei, unterstützen die photosynthetischen Prozesse und verbessern die Nährstoffaufnahme aus dem Boden.
Zusammenfassend lässt sich sagen, dass Salze unverzichtbare Bestandteile biologischer Systeme sind und vielfältige Rollen in zahlreichen physiologischen Prozessen übernehmen.