Welche Salze gibt es in der Chemie? Beispiele
Salze spielen eine grundlegende Rolle in der Chemie und sind durch ihre molekulare Beziehung zwischen Kationen und Anionen gekennzeichnet. Diese Verbindungen entstehen durch ionische Bindungen, bei denen positiv geladene Kationen und negativ geladene Anionen in einem bestimmten Ionenverhältnis aufeinandertreffen. Die chemische Formel eines Salzes gibt dabei die stöchiometrischen Zahlen der einzelnen Ionen an.
Das Konzept der elektrischen Neutralität ist entscheidend für die Zusammensetzung von Salzen, da ihr Gitter aus Kationen und Anionen stets ein ausgeglichenes Gesamtladungsverhältnis aufweist. Häufig bestimmen die gewichteten Summenformeln die kristalline Struktur dieser Verbindungen, wobei gesetzmäßige Proportionen und chemische Symmetrie eine Schlüsselrolle spielen. Durch elektrostatische Anziehung werden diese Ionen festgehalten, was zur Freisetzung oder Speicherung von Gitterenergie führt.
Das Wichtigste in Kürze
- Salze bestehen aus Kationen und Anionen und sind elektrisch neutral.
- Natriumchlorid (NaCl) wird als Würzmittel und in der Industrie verwendet.
- Salze wie CaCO₃ und MgSO₄ finden Einsatz in Medizin und Bauwesen.
- Ammoniumnitrat (NH₄NO₃) dient als Düngemittel und Sprengstoff.
- Ionische Bindungen und Gitterenergie bestimmen die Stabilität von Salzen.
In der Chemie gibt es eine Vielzahl von Salzen mit unterschiedlichen Anwendungen. Ein häufig verwendetes Salz ist Natriumchlorid, auch bekannt als Kochsalz, das in der Lebensmittelindustrie, Medizin und Chemie verwendet wird. Ein weiteres Beispiel ist Calciumcarbonat, das in der Bauindustrie, bei der Herstellung von Zement und in der Landwirtschaft als Kalkdünger eingesetzt wird. Zinkchlorid ist ein weiteres Salz, das in Batterien, Galvanotechnik und als Katalysator Verwendung findet.
Beispiele für Salze in der Chemie
- Natriumchlorid (NaCl)
- Kaliumnitrat (KNO₃)
- Calciumcarbonat (CaCO₃)
- Eisen(II)-sulfat (FeSO₄)
- Aluminiumoxid (Al₂O₃)
- Magnesiumchlorid (MgCl₂)
- Kupfer(II)-sulfat (CuSO₄)
- Zinkacetat (Zn(CH₃COO)₂)
- Natriumhydroxid (NaOH)
- Kaliumpermanganat (KMnO₄)
- Silbernitrat (AgNO₃)
- Bariumsulfat (BaSO₄)
- Natriumcarbonat (Na₂CO₃)
- Ammoniumchlorid (NH₄Cl)
- Kaliumsulfat (K₂SO₄)
- Calciumchlorid (CaCl₂)
- Zinksulfat (ZnSO₄)
- Eisen(III)-chlorid (FeCl₃)
- Natriumacetat (CH₃COONa)
- Kaliumchlorid (KCl)
- Kupfer(I)-chlorid (CuCl)
- Magnesiumsulfat (MgSO₄)
- Aluminiumchlorid (AlCl₃)
- Natriumsulfat (Na₂SO₄)
Natriumchlorid (Kochsalz) in Haushalt und Industrie
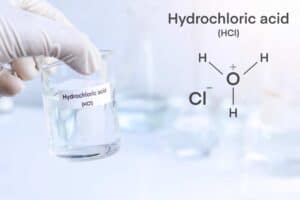
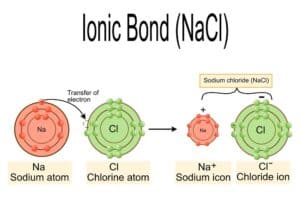
Natriumchlorid, besser bekannt als Kochsalz, spielt sowohl im Haushalt als auch in der Industrie eine wesentliche Rolle. Die chemische Formel von Natriumchlorid lautet NaCl und es entsteht durch eine ionische Bindung zwischen dem Kation Na+ und dem Anion Cl–. Diese molekulare Beziehung hält das Salz stabil und verleiht ihm seine kristalline Struktur.
Im Haushalt ist Natriumchlorid oft als Würzmittel in der Küche zu finden. Es wird zum Verfeinern von Speisen verwendet, um den Geschmack zu verbessern. Darüber hinaus dient es als Konservierungsmittel, da es Bakterienwachstum hemmt.
In industriellen Anwendungen nutzt man Natriumchlorid zur Herstellung von Chlor und Natronlauge durch die Chlor-Alkali-Elektrolyse. Zudem findet es Anwendung in der Wasseraufbereitung, wo es genutzt wird, um Härtebildner wie Calcium- und Magnesiumionen zu entfernen.
Die elektrische Neutralität des Salzes ergibt sich aus dem ausgeglichenen Ionenverhältnis. In der Chemie spricht man bei Natriumchlorid von einer einfachen gewichteten Summenformel, was bedeutet, dass das Verhältnis der Atome in gesetzmäßigen Proportionen vorliegt. Diese regelmäßige Anordnung führt zu einer hohen Gitterenergie, welche eine wichtige Rolle bei vielen der industriellen Prozesse spielt.
Natriumchlorid zeigt eindrücklich, wie vielseitig die Anwendungsmöglichkeiten eines einfachen Salzes sein können und wie eng die verschiedenen Aspekte dieses Stoffes miteinander verflochten sind.
Salz ist von den reinsten Eltern geboren: der Sonne und dem Meer. – Pythagoras
| Eigenschaft | Beschreibung |
|---|---|
| Kochsalz (Natriumchlorid) | Verwendet als Würzmittel, Konservierungsmittel und in der Chlor-Alkali-Elektrolyse |
| Ionische Bindung | Verbindung zwischen Kation Na+ und Anion Cl– |
| Ionenverhältnis | 1:1 (Na+ : Cl–) |
| Gewichtete Summenformel | NaCl |
| Elektrische Neutralität | Ausgeglichenes Verhältnis von Kationen und Anionen |
| Kristalline Struktur | Regelmäßige Anordnung der Ionen in gesetzmäßigen Proportionen |
| Gitterenergie | Hohe energetische Stabilität durch starke elektrostatische Anziehung |
Calciumcarbonat (Kalk) in Bauwesen und Medizin
- Name: Calciumcarbonat
- Chemische Formel: CaCO₃
- Eigenschaften: Calciumcarbonat ist ein weißes, geruchloses Pulver, das in Wasser praktisch unlöslich ist. Es kommt in der Natur in verschiedenen Formen vor, darunter als Kalkstein, Marmor und Kreide.
- Verwendung: Calciumcarbonat wird in der Bauindustrie zur Herstellung von Zement, in der Landwirtschaft als Kalkdünger, in der Lebensmittelindustrie als Zusatzstoff und in der Pharmazie als Calciumpräparat verwendet.
- Sonstiges: Calciumcarbonat spielt eine wichtige Rolle im Kohlenstoffkreislauf und ist ein Bestandteil von Muschelschalen, Korallenriffen und Kalkgestein.
Calciumcarbonat, oft als Kalk oder Kreide bekannt, spielt eine entscheidende Rolle sowohl im Bauwesen als auch in der Medizin. Dessen Bedeutung liegt in seinen vielfältigen physikalischen und chemischen Eigenschaften.
Im Bauwesen wird Calciumcarbonat hauptsächlich zur Herstellung von Zement und Mörtel verwendet. Durch die reaktive Chemie, insbesondere die Bindung von Kohlendioxid aus der Luft, trägt es zur Härtung und Festigkeit von Baustoffen bei. Es bildet häufig die Grundlage für verschiedene Bauprodukte dank seiner stabilen, kristallinen Struktur und festen Eigenschaften.
In der Medizin hat Calciumcarbonat ebenso vielseitige Anwendungen. Es dient oft als Antazidum zur Neutralisierung überschüssiger Magensäure und ist ein wichtiger Bestandteil vieler Kalziumpräparate, die den Kalziumspiegel im Körper regulieren. Dadurch unterstützt es die Gesundheit von Knochen und Zähnen.
Die chemische Formel CaCO₃ zeigt, dass dieses Salz aus einem Calcium-Kation (Ca²⁺) und einem Carbonat-Anion (CO₃²⁻) besteht. Diese Ionen sind durch ionische Bindungen verbunden, was zu einer elektrischen Neutralität des Salzes führt. Die molekulare Beziehung und das Verhältnis dieser Ionen spiegeln sich in der klaren Strukturformel wider und stellen sicher, dass das Material seine Robustheit und Stabilität beibehält.
Magnesiumsulfat (Bittersalz) als Dünger und Heilmittel
- Name: Magnesiumsulfat
- Chemische Formel: MgSO₄
- Eigenschaften: Magnesiumsulfat, auch bekannt als Bittersalz, ist ein farbloser Feststoff, der gut in Wasser löslich ist. Es hat einen bitteren Geschmack und wird häufig in Form von kristallinen Granulaten verkauft.
- Verwendung: Magnesiumsulfat wird in der Medizin als Abführmittel, in der Landwirtschaft als Magnesiumdünger, in der Kosmetik zur Herstellung von Badezusätzen und in der Chemie als Reagenz verwendet.
- Sonstiges: Bittersalz kann auch in der Gartenarbeit zur Behandlung von Magnesiummangel in Pflanzen eingesetzt werden. Es hat auch Anwendungen in der Tiermedizin und wird manchmal als Hausmittel für verschiedene Zwecke verwendet.
Magnesiumsulfat, auch bekannt als Bittersalz, ist ein häufig verwendetes Düngemittel in der Landwirtschaft. Es liefert wichtige Mikronährstoffe wie Magnesium und Schwefel, die für das Wachstum von Pflanzen unerlässlich sind. Magnesium ist ein zentraler Bestandteil des Chlorophylls, welches für die Photosynthese benötigt wird. Schwefel trägt zur Herstellung von Aminosäuren bei, den Bausteinen von Proteinen.
In der Verwendung als Heilmittel ist Magnesiumsulfat ebenfalls vielseitig. Aufgrund seiner entzündungshemmenden Eigenschaften wird es oft in Form von Bädern oder Umschlägen eingesetzt. Diese Anwendungen können helfen, Muskelschmerzen und Krämpfe zu lindern. Darüber hinaus findet Magnesiumsulfat als Abführmittel Anwendung. Es wirkt durch die Erhöhung des Wassergehalts im Darm, wodurch die Verdauung angeregt wird.
Im chemischen Kontext basiert die Struktur dieses Salzes auf einer ionischen Bindung zwischen dem Kation (Mg²⁺) und dem Anion (SO₄²⁻). Die Formel lautet MgSO₄, was die chemische Beziehung und Neutralität zeigt. Das Ionenverhältnis in der Verbindung folgt den gesetzmäßigen Proportionen, wodurch eine elektrische Neutralität erhalten bleibt.Die elektrostatische Anziehungkräfte innerhalb des Kristallgitters tragen zur Stabilisierung des Salzes bei. Die kristalline Struktur von Magnesiumsulfat macht es besonders effektiv in seinen Anwendungen sowohl als Dünger als auch als therapeutisches Mittel.
Natriumhydrogencarbonat (Natron) zur Reinigung und Backen
- Name: Natriumhydrogencarbonat
- Chemische Formel: NaHCO₃
- Eigenschaften: Natriumhydrogencarbonat, auch bekannt als Natron, ist ein weißes Pulver, das in Wasser löslich ist. Es kann beim Erhitzen zerfallen und Kohlendioxid abgeben.
- Verwendung: Natron wird in der Lebensmittelindustrie als Backtriebmittel, in der Reinigung als vielseitiges Hausmittel, in der Medizin zur Behandlung von Sodbrennen und als Geruchsneutralisierer eingesetzt.
- Sonstiges: Natron hat auch Anwendungen in der Chemie, bei der Herstellung von Feuerlöschern und in der Umwelttechnik zur Neutralisation von sauren Abwässern. Es ist ein vielseitiges und weit verbreitetes Allzweckmittel im Haushalt.
Natriumhydrogencarbonat, auch bekannt als Natron oder Backsoda, ist ein bemerkenswert vielseitiges Salz. Seine chemische Formel lautet NaHCO3. Diese Substanz wird wegen ihrer zahlreichen Anwendungen im Haushalt und in der Industrie geschätzt.
Beim Backen fungiert Natron als Triebmittel, das die Teige durch Freisetzung von Kohlenstoffdioxid auflockert. Dieser Prozess ist das Ergebnis einer Reaktion zwischen dem Natriumhydrogencarbonat und Säuren wie Essig oder Zitronensaft. Das entstehende Gas sorgt dafür, dass Gebäck volumiger und leichter wird.
Ein weiterer bedeutender Einsatzbereich von Natron ist die Reinigung. Dank seiner milden abrasiven Wirkung kann es hartnäckige Verschmutzungen effektiv entfernen, ohne empfindliche Oberflächen zu beschädigen. Es wirkt besonders gut bei der Reinigung von Küchenoberflächen, wo organische Rückstände entfernt werden müssen. Als umweltfreundliches Reinigungsmittel hinterlässt es keine schädlichen Rückstände und ist biologisch abbaubar.
In industriellen Anwendungen findet sich Natron ebenfalls wieder. Dort wird es unter anderem zur Regulierung des pH-Werts eingesetzt. Dies spielt vor allem in der Lebensmittelindustrie eine wichtige Rolle, wo die Kontrollierbarkeit von Säuren und Basen entscheidend für die Produktqualität ist.
Zusätzlich verfügt Natriumhydrogencarbonat über medizinische Anwendungen. Es kann zum Beispiel in geringeren Mengen Magenübersäuerung lindern. Zu diesem Zweck neutralisiert es überschüssige Magensäure, indem es in Wasser gelöst wird.
Der Gebrauch von Natriumhydrogencarbonat zeigt eindrucksvoll die Bandbreite der Chemie der Salze. Die ionische Bindung zwischen dem Kation (Na+) und dem Anion (HCO3-) resultiert in einer stabilen kristallinen Struktur.
Ammoniumnitrat als Düngemittel und Sprengstoff
Ein vielseitiges Salz, das sowohl in der Landwirtschaft als auch in anderen Bereichen eingesetzt wird, ist Ammoniumnitrat. Dieses Salz besteht aus den Ionen Ammonium (NH4+) und Nitrat (NO3–). Die chemische Formel für Ammoniumnitrat lautet NH4NO3.
Als Düngemittel spielt es eine bedeutende Rolle in der Landwirtschaft, da es Pflanzen mit notwendigen Nährstoffen wie Stickstoff versorgt. Der hohe Stickstoffgehalt fördert das Wachstum und die Entwicklung von Pflanzen, wodurch höhere Erträge erzielt werden können. Dies macht Ammoniumnitrat zu einem unverzichtbaren Bestandteil moderner Agrartechniken.
Jedoch ist Ammoniumnitrat nicht nur auf positive Anwendungen beschränkt. Es kann auch als Ausgangsstoff für explosiv wirkende Sprengstoffe genutzt werden. Aufgrund seiner starken oxidierenden Eigenschaften wird es sowohl im zivilen Bauwesen als auch in der Bergbauindustrie verwendet. Dabei dient es dazu, kontrollierte Sprengungen durchzuführen, um beispielsweise Gestein abzutragen.
Ammoniumnitrat kristallisiert in einer typischen ionischen Bindung zwischen Kationen und Anionen, was zur elektrischen Neutralität des Salzes führt. Die kristalline Struktur dieses Salzes folgt gesetzmäßigen Proportionen und zeigt eine beachtliche Gitterenergie. Die molekulare Beziehung zwischen seinen Komponenten beeinflusst sowohl seine physiologischen als auch physikalisch-chemischen Eigenschaften.
Die chemische Berechnung der stöchiometrischen Zahlen und das Verständnis der gewichteten Summenformel sind wichtig für die sichere Handhabung und Anwendung dieses vielseitigen Salzes.
| Salz | Verwendung | Chemische Formel |
|---|---|---|
| Calciumcarbonat | Bauwesen, Medizin | CaCO₃ |
| Magnesiumsulfat | Dünger, Heilmittel | MgSO₄ |
| Ammoniumnitrat | Düngemittel, Sprengstoff | NH₄NO₃ |
Kaliumpermanganat für Wasseraufbereitung und Medizin
- Name: Kaliumpermanganat
- Chemische Formel: KMnO₄
- Eigenschaften: Kaliumpermanganat ist ein tiefviolettes bis schwarzes kristallines Pulver, das in Wasser gut löslich ist. Es zersetzt sich bei Erhitzung und kann gefährliche oxidierende Eigenschaften haben.
- Verwendung: Kaliumpermanganat wird in der Medizin zur Desinfektion von Wunden, als Oxidationsmittel in der Chemie, zur Wasseraufbereitung und in der Analytik eingesetzt.
- Sonstiges: Aufgrund seiner starken oxidierenden Eigenschaften wird Kaliumpermanganat mit Vorsicht verwendet und sollte nicht unkontrolliert mit organischen Stoffen in Kontakt kommen. Es hat auch Anwendungen in der Aquaristik und bei der Reinigung von Brunnenwasser.
Kaliumpermanganat ist eine chemische Verbindung, die sowohl in der Wasseraufbereitung als auch in der Medizin häufig verwendet wird. Es besitzt die chemische Formel KMnO4, wobei es ein Kation (K+) und ein Anion (MnO4–) enthält. Diese Zusammensetzung ermöglicht eine zuverlässige ionische Bindung zwischen den Atomen.
In der Wasseraufbereitung dient Kaliumpermanganat zur Oxidation von organischen Stoffen und Verunreinigungen. Das führt dazu, dass unerwünschte Substanzen durch eine elektrostatische Anziehung gebunden und aus dem Wasser entfernt werden können. Auch Bakterien und Algen im Wasser werden so effizient reduziert.
Medizinisch gesehen wird Kaliumpermanganat oft als Antiseptikum genutzt. Es kann auf verschiedene Weisen aufgetragen werden, etwa als Lösung oder Salbe. Die kristalline Struktur des Stoffes macht ihn dabei besonders effektiv gegen mikrobiellen Befall, da er das Gewebe oxidiert und somit desinfiziert.
Kaliumpermanganat spielt also eine wichtige Rolle bei der Reinigung und Aufbereitung von Wasser sowie im Gesundheitsbereich. Durch seine hohe Oxidationskraft und die spezifischen gesetzmäßigen Proportionen der enthaltenen Ionen wird seine Anwendung vielfältig und nützlich gestaltet.
Kupfersulfat in Landwirtschaft und Galvanik
- Name: Kupfersulfat
- Chemische Formel: CuSO₄
- Eigenschaften: Kupfersulfat ist ein blaues bis blaugrünes Pulver oder Kristalle, die in Wasser gut löslich sind. Es hat eine leicht saure Reaktion und wird oft als Kupfervitriol bezeichnet.
- Verwendung: Kupfersulfat wird in der Landwirtschaft als Fungizid und zur Bekämpfung von Algen eingesetzt, in der Chemie als Katalysator, in der Galvanotechnik und zur Herstellung von Pigmenten.
- Sonstiges: Kupfersulfat hat auch Anwendungen in der Tiermedizin zur Behandlung von Kupfermangel bei Nutztieren und in der Elektronik zur Herstellung von Leiterplatten. Es ist wichtig, die Handhabung von Kupfersulfat aufgrund seiner toxischen Eigenschaften zu beachten.
Kupfersulfat, auch bekannt als Kupfervitriol, spielt eine entscheidende Rolle in der Agrarwirtschaft und Industrie. Dieses Salz hat die chemische Formel CuSO4 und besteht aus dem Kation Cu2+ und dem Anion SO42-. Diese Verbindung bildet typischerweise kristalline Strukturen und zeigt eine deutliche blaue Farbe, was auf seine chemische Symmetrie hinweist.
In der Landwirtschaft wird Kupfersulfat hauptsächlich als Fungizid eingesetzt. Es hilft beispielsweise dabei, Pflanzenkrankheiten zu bekämpfen, indem es Pilzbefall verhindert und bestehende Infektionen behandelt. Dies geschieht durch Schädigung der Zellmembranen von Pilzzellen, was auf die starke elektrostatische Anziehung zwischen den Ionen im Kupfersulfat zurückzuführen ist.
Ein weiterer wichtiger Einsatzbereich für dieses Salz ist die Galvanik. Hier wird Kupfersulfat verwendet, um Metalloberflächen zu beschichten und zu veredeln. Dabei werden die Kupfer-Ionen in einem elektrochemischen Prozess auf die Oberfläche des zu behandelnden Metalls übertragen. Dieser Vorgang beruht auf der Gitterenergie und den Gesetzmäßigkeiten der ionischen Bindung, die für stabile metallische Überzüge sorgen.
Die chemische Berechnung und das Verständnis der stöchiometrischen Zahlen sind hier besonders wichtig, da sie genaue Angaben über die benötigten Mengen an Kupfersulfat liefern. Dies stellt sicher, dass die Strukturformel des Endprodukts exakt dem gewünschten Ergebnis entspricht und somit optimale Ergebnisse erzielt werden.
Eisen(III)-chlorid zur Abwasserbehandlung und Fototechnik
- Name: Eisen(III)-chlorid
- Chemische Formel: FeCl₃
- Eigenschaften: Eisen(III)-chlorid ist ein gelbbraunes bis rostbraunes Pulver oder Kristalle, die in Wasser gut löslich sind. Es ist hygroskopisch und bildet leicht wässrige Lösungen.
- Verwendung: Eisen(III)-chlorid wird in der Chemie als Katalysator, zur Ätzen von Leiterplatten, in der Abwasserbehandlung, als Fällungsmittel und in der Textilindustrie eingesetzt.
- Sonstiges: Eisen(III)-chlorid hat auch Anwendungen in der Herstellung von Farbstoffen, Arzneimitteln und bei der Synthese von organischen Verbindungen. Es ist ein vielseitiges Salz mit wichtigen Funktionen in verschiedenen Industriezweigen.
Eisen(III)-chlorid, auch bekannt als FeCl3, ist ein vielseitig verwendetes Salz in der Chemie. Es besteht aus Eisen-Ionen (Fe³⁺) und Chlorid-Ionen (Cl⁻). Diese Substanz wird häufig wegen ihrer starken Fällungseigenschaften eingesetzt.
In der Abwasserbehandlung spielt Eisen(III)-chlorid eine wichtige Rolle. Es dient zur Fällung von Phosphaten und hilft dabei, organische Verunreinigungen aus dem Wasser zu entfernen. Dabei nutzt es die Prinzipien der elektrostatischen Anziehung zwischen den negativ geladenen Schadstoffen und den positiv geladenen Eisen-Ionen. Durch diese ionische Bindung entstehen schwerlösliche Verbindungen, die sich abscheiden lassen.
Ein weiterer bedeutender Einsatzort für Eisen(III)-chlorid ist die Fototechnik, speziell in der Entwicklung von Fotografien. In dieser Branche wird es in der Herstellung von lichtempfindlichen Materialien und zum Ätzen von Metalloberflächen verwendet. Die Fähigkeit von FeCl3, unter bestimmten Bedingungen Elektronen abzugeben oder aufzunehmen, macht es besonders wertvoll in solchen chemischen Prozessen.
Nicht nur seine Anwendungen sind vielfältig, sondern auch seine chemische Struktur. Eine detaillierte Betrachtung zeigt, dass Eisen(III)-chlorid durch eine komplexe ionische Bindung gekennzeichnet ist, die auf dem Austausch von Elektronen basiert. Hierbei entsteht eine kristalline Struktur, welche die besondere Stabilität des Salzes erklärt.
Das Ionenverhältnis in Eisen(III)-chlorid entspricht der chemischen Formel FeCl3, und dieses Verhältnis stellt sicher, dass die elektrische Neutralität des gesamten Moleküls gewahrt bleibt. Diese Eigenschaften machen Eisen(III)-chlorid zu einem unverzichtbaren Bestandteil sowohl in der Wasseraufbereitung als auch in der Fototechnik.