Verhältnisformel von Salzen stellen die kleinsten Einheit eines ionischen Stoffes dar, die aus positiv geladenen Kationen und negativ geladenen Anionen besteht. Diese Formeln repräsentieren das einfachste ganze Zahlenverhältnis der Ionen im Kristallgitter des Salzes. Die Ionenbildung erfolgt durch den Austausch von Elektronen zwischen Atomen, wobei der Ladungsausgleich entscheidend ist.
In typischen Beispielen wie Natriumchlorid (NaCl) oder Magnesiumoxid (MgO) zeigt die Verhältnisformel deutlich die chemische Zusammensetzung des Salzes. Diese Darstellung hilft dabei zu verstehen, wie sich die einzelnen Ionen in festen Strukturen anordnen und welche chemischen Eigenschaften daraus resultieren.
Das Wichtigste in Kürze
- Verhältnisformeln geben das Verhältnis von Kationen und Anionen in Salzen an, z.B. NaCl oder CaF₂.
- Ionenbildung durch Elektronenübergabe führt zu stabilen, elektrisch neutralen Salzen.
- Typische Salzeigenschaften: hohe Schmelz- und Siedepunkte, Wasserlöslichkeit und kristalline Strukturen.
- Verhältnisformeln sind essentiell für industrielle Anwendungen und chemische Reaktionsberechnungen.
- Salze werden vielseitig in Bauwirtschaft, Lebensmittel- und Pharmaindustrie verwendet.
Die Verhältnisformel von Salzen gibt das Verhältnis der enthaltenen Ionen in einem Salz an. Es zeigt, wie viele positive und negative Ionen in einem Salz vorhanden sind und in welchem Verhältnis sie miteinander verbunden sind. Die Verhältnisformel ermöglicht es, die chemische Zusammensetzung eines Salzes genau zu beschreiben.
Definition Verhältnisformel von Salzen
Die Verhältnisformel von Salzen beschreibt das Mengenverhältnis der Ionen, aus denen das Salz besteht. Im Gegensatz zu Molekülverbindungen, die spezifische Atome in festen Zahlenverhältnissen auflisten, gibt die Verhältnisformel nur das Verhältnis der unterschiedlichen Ionen an.
Das bedeutet, dass es sich bei der Verhältnisformel nicht um eine exakte Summenformel handelt, sondern um eine Angabe, wie viele Kationen zu wie vielen Anionen im Salz vorhanden sind. Zum Beispiel ist die Verhältnisformel für Natriumchlorid (NaCl) 1:1. Dies zeigt, dass ein Natriumion (Na⁺) genau einem Chloridion (Cl⁻) gegenübersteht.
Ein weiteres typisches Beispiel ist Calciumfluorid (CaF₂), welches die Verhältnisformel 1:2 besitzt. Das bedeutet, dass auf ein Calciumion (Ca²⁺) zwei Fluoridionen (F⁻) kommen. Diese Art der Schreibweise ist essenziell, um die elektrische Neutralität des Salzes darzustellen.
Diese Formeln helfen Chemikern und anderen Fachleuten, die Zusammensetzung und Eigenschaften von verschiedenen Salzen schnell zu verstehen, ohne dass eine detaillierte Analyse notwendig ist. Zudem ermöglicht die Verwendung von Verhältnisformeln die einfache Berechnung chemischer Reaktionen und stöchiometrischer Verhältnisse, was sowohl in der Forschung als auch in industriellen Anwendungen immens wichtig ist.
Die Chemie ist die Wissenschaft von den Stoffen, deren Eigenschaften, Aufbau und Umwandlungen. – Hermann Staudinger
| Beispiel | Verhältnisformel |
|---|---|
| Natriumchlorid | NaCl |
| Calciumfluorid | CaF₂ |
| Bariumchlorid | BaCl₂ |
| Magnesiumoxid | MgO |
| Aluminiumoxid | Al₂O₃ |
Beispiele auf einem Blick
- Natriumchlorid (NaCl): Natriumionen (Na⁺) und Chloridionen (Cl⁻) im Verhältnis 1:1
- Calciumcarbonat (CaCO₃): Calciumionen (Ca²⁺) und Carbonationen (CO₃²⁻) im Verhältnis 1:1
- Natriumhydrogencarbonat (NaHCO₃): Natriumionen (Na⁺) und Hydrogencarbonationen (HCO₃⁻) im Verhältnis 1:1
- Kaliumnitrat (KNO₃): Kaliumionen (K⁺) und Nitrationen (NO₃⁻) im Verhältnis 1:1
- Aluminiumoxid (Al₂O₃): Aluminiumionen (Al³⁺) und Oxidionen (O²⁻) im Verhältnis 2:3
- Magnesiumsulfat (MgSO₄): Magnesiumionen (Mg²⁺) und Sulfationen (SO₄²⁻) im Verhältnis 1:1
- Eisensulfid (FeS): Eisenionen (Fe²⁺) und Sulfidionen (S²⁻) im Verhältnis 1:1
- Kupfer(II)-sulfat (CuSO₄): Kupferionen (Cu²⁺) und Sulfationen (SO₄²⁻) im Verhältnis 1:1
- Natriumsulfat (Na₂SO₄): Natriumionen (Na⁺) und Sulfationen (SO₄²⁻) im Verhältnis 2:1
- Kaliumchlorid (KCl): Kaliumionen (K⁺) und Chloridionen (Cl⁻) im Verhältnis 1:1
- Magnesiumchlorid (MgCl₂): Magnesiumionen (Mg²⁺) und Chloridionen (Cl⁻) im Verhältnis 1:2
- Zinkoxid (ZnO): Zinkionen (Zn²⁺) und Oxidionen (O²⁻) im Verhältnis 1:1
- Die Verhältnisformel für Natriumhyaluronat lautet NaC₁₄H₂₁NO₁₁.
Eigenschaften typischer Salze
Salze sind chemische Verbindungen, die aus positiven und negativen Ionen bestehen. Diese Ionen werden durch ionische Bindungen zusammengehalten, was den Salzen ihre typischen physikalischen und chemischen Eigenschaften verleiht.
Eine bemerkenswerte Eigenschaft von Salzen ist ihre hohe Schmelz- und Siedetemperatur. Dies liegt daran, dass die starke Anziehungskraft zwischen den Ionen in einem Kristallgitter überwunden werden muss, um die Struktur zu verändern. Daher können Salze in der Regel nur bei sehr hohen Temperaturen geschmolzen oder verdampft werden.
Des Weiteren sind viele Salze wasserlöslich. In Wasser dissoziieren sie in ihre einzelnen Ionen, was dem Wasser eine elektrische Leitfähigkeit verleiht. Diese Eigenschaft macht Salze nützlich in zahlreichen industriellen Anwendungen wie der Elektrolyse.
Auch ist es wichtig zu wissen, dass feste Salze in kristallinen Strukturen vorliegen. Diese Kristalle haben oft geometrisch regelmäßige Formen, zum Beispiel würfelförmig oder prismatisch. Die klare Struktur der Kristalle kann auch unter dem Mikroskop beobachtet werden und ist ein weiteres Merkmal typischer Salze.
Zusammenfassend lassen sich typische Eigenschaften von Salzen auf ihre ionische Natur zurückführen. Hohe Schmelzpunkte, Wasserlöslichkeit und kristalline Strukturen prägen ihr Verhalten und ihre vielseitigen Anwendungen.
Ionenbildung und Ladungsausgleich
In einem Salz sind Kationen und Anionen durch ionische Bindungen zusammengehalten. Diese Ionen entstehen durch die Elektronenübergabe zwischen Atomen. Metalle neigen dazu, Elektronen abzugeben und bilden daher Kationen. Nichtmetalle nehmen diese Elektronen auf und werden zu Anionen.
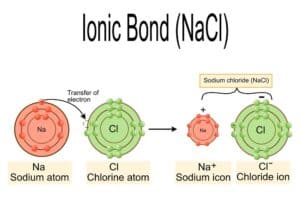
Ein entscheidender Punkt ist der Ladungsausgleich. In einem stabilen Salz müssen die positiven und negativen Ladungen ausgeglichen sein, sodass die Gesamtladung des Salzes null beträgt. Zum Beispiel bildet Natrium (Na) ein einfach positiv geladenes Kation (Na⁺), während Chlor (Cl) ein einfach negativ geladenes Anion (Cl⁻) bildet. Das Ergebnis ist das bekannte Kochsalz NaCl.
Wie sieht es bei komplexeren Zusammensetzungen aus? Ein Calciumatom (Ca) gibt zwei Elektronen ab und wird somit zu einem Ca²⁺-Ion. Phosphat (PO₄³⁻) hingegen hat eine dreifach negative Ladung. Um hier den Ladungsausgleich zu erreichen, bedarf es einer entsprechenden Stoichiometrie: Drei Ca²⁺-Ionen balancieren zwei PO₄³⁻-Ionen aus, was zur Verhältnisformel Ca₃(PO₄)₂ führt.
Dieser Ausgleich ist essenziell für das Verständnis der Verhältnisformel von Salzen, da sie die Grundlage für die chemische Stabilität und Reaktionsfähigkeit dieser Substanzen darstellt.
Beispiele häufiger Verhältnisformeln genauer erklärt
- Ein häufig anzutreffendes Beispiel ist das Salz Natriumchlorid (NaCl). Hier bilden Natriumionen (Na⁺) und Chloridionen (Cl⁻) ein kristallines Gitter mit einem einfachen 1:1-Verhältnis.
- Ein weiteres gängiges Beispiel ist Calciumchlorid (CaCl₂), bei dem Calciumionen (Ca²⁺) mit zwei Chloridionen (Cl⁻) kombiniert werden, um die elektrische Neutralität zu wahren. Dies zeigt deutlich, wie der Ladungsausgleich eine essentielle Rolle in der Verhältnisformel von Salzen spielt.
- Magnesiumoxid (MgO) ist ebenfalls sehr weit verbreitet. Hier verbinden sich Magnesiumionen (Mg²⁺) mit Oxidionen (O²⁻) im Verhältnis 1:1. Diese Formel demonstriert, wie Ionen aus verschiedenen Gruppen des Periodensystems zusammenwirken können.
- Bei Aluminiumoxid (Al₂O₃) komplexer: Aluminiumionen (Al³⁺) benötigen drei Sauerstoffionen (O²⁻) für einen ausgeglichenen Zustand. Das Ergebnis ist eine Verhältnisformel von zwei Aluminium- zu drei Sauerstoffatomen.
Diese Beispiele zeigen die Vielfalt an Verhältnisformeln und deren Notwendigkeit zur Einhaltung spezifischer ionischer Verhältnisse. Sie verdeutlichen auch, dass sowohl einfache als auch komplexere Formen existieren, abhängig von den beteiligten Ionentypen.
Berechnung der Verhältnisformel
Um die Verhältnisformel von Salzen zu berechnen, gilt es zunächst, die Ladungen der beteiligten Ionen zu identifizieren. Diese ergeben sich aus den Elementen bzw. ihren Positionen im Periodensystem. Natrium (Na), ein typisches Beispiel aus Gruppe 1, bildet einfach positiv geladene Kationen (Na+). Chlor hingegen, aus Gruppe 17, bildet einfach negativ geladene Anionen (Cl–).
Ein wichtiger Schritt besteht darin, sicherzustellen, dass die Gesamtladung des entstandenen Salzes neutral ist. Dies wird durch einen Ladungsausgleich der beteiligten Ionen erreicht. Beispielsweise reagiert Na+ mit Cl– zu NaCl, wobei eine 1:1-Verbindung entsteht.
Bei komplexeren Verbindungen ist das Prinzip dasselbe. Nehmen wir Calciumchlorid (CaCl2) als Beispiel. Calcium bildet Ca2+-Ionen und Chlor wie bereits erwähnt Cl–. Um elektrische Neutralität zu gewährleisten, benötigt man zwei Cl2-Anionen für jedes Ca2+-Kation, was zur Verhältnisformel CaCl2 führt.
Dieser Prozess lässt sich verallgemeinern: Bestimmen Sie zuerst die Oxidationszahlen der Ionen und gleichen Sie dann ihre Summen aus, um die richtige Kombination zu finden. Ein weiteres Beispiel wären Magnesium- (Mg2+) und Phosphor-Ionen (P3-). In diesem Fall ergibt die korrekte Ausbalancierung die Formel Mg3P2, da drei Mg2+-Ionen mit zwei P3--Ionen reagieren.
Auf diese Weise lassen sich die Verhältnisformen vieler unterschiedlicher Salze systematisch bestimmen.
| Salzname | Formel | Kationen/Anionen-Verhältnis |
|---|---|---|
| Kupfersulfat | CuSO₄ | 1:1 |
| Kaliumbromid | KBr | 1:1 |
| Eisensulfid | FeS | 1:1 |
| Bleinitrat | Pb(NO₃)₂ | 1:2 |
Reaktionen und Produktbildung
Beim Reagieren von Salzen und der Bildung neuer Produkte spielt die Verhältnisformel eine entscheidende Rolle. Wenn sich zwei verschiedene Ionenarten miteinander verbinden, streben sie danach, ein stabiles Kristallgitter zu bilden. Dies erfordert einen exakten Ladungsausgleich zwischen den beteiligten Kationen und Anionen.
Ein klassisches Beispiel ist die Reaktion von Natrium (Na) mit Chlor (Cl). Natrium gibt ein Elektron ab und wird zu einem positiv geladenen Natrium-Ion (Na⁺), während Chlor ein Elektron aufnimmt und zu einem negativ geladenen Chlorid-Ion (Cl⁻) wird. Die entstehende Verbindung NaCl ist das allseits bekannte Kochsalz. Hierbei gleicht die positive Ladung des Natriums die negative Ladung des Chlors aus, was zur Stabilisierung des Kristallgitters führt.
Ähnlich verhält es sich bei anderen Salzen wie Calciumchlorid. Wenn Calcium (Ca) reagiert, entstehen Ca²⁺-Ionen, welche jeweils zwei Cl⁻-Ionen benötigen, um die elektrische Neutralität im Kristall sicherzustellen. Das Ergebnis ist die Verhältnisformel CaCl₂.
Zusammengefasst erleichtert die Verhältnisformel somit nicht nur das Verständnis der chemischen Struktur eines Salzes, sondern auch dessen Bildungsprozess. Sie spiegelt wider, wie viele Ionen jedes Elements benötigt werden, um eine stabilisierte, elektrisch neutrale Verbindung zu formen.
Bedeutung in der Chemie
Die Verhältnisformel von Salzen spielt eine zentrale Rolle in der Chemie, da sie das stöchiometrische Verhältnis der Ionen in einer chemischen Verbindung bestimmt. Diese Formeln sind nicht nur akademisch von Bedeutung, sondern auch praktisch, besonders bei der Herstellung und Analyse chemischer Substanzen.
Durch die korrekte Anwendung der Verhältnisformeln können Chemiker präzise Vorhersagen über die Reaktionen und Eigenschaften eines Salzes machen. Dies ist essenziell bei der Entwicklung neuer Materialien wie Legierungen oder bei der Synthese wichtiger Verbindungen in der pharmazeutischen Industrie.
Verhältnisformeln ermöglichen es zudem, das Verständnis für Kristallstrukturen zu vertiefen. Sie helfen beim Erkennen der geometrischen Anordnung der Atome und führen somit zu wichtigen Erkenntnissen in der Materialwissenschaft.
Letztendlich unterstützt das Wissen über Verhältnisformeln die Genauigkeit in vielen chemischen Anwendungen – von alltäglichen Prozessen wie der Wasserenthärtung bis hin zur Hightech-Produktion in der Mikroelektronik.
Anwendung in der Industrie
Salze sind von entscheidender Bedeutung in der Industrie und werden in vielfältigen Bereichen verwendet. Ein prominentes Beispiel ist die Chemieindustrie, wo sie als Ausgangsstoffe für eine Vielzahl chemischer Reaktionen dienen. Hierbei kommen insbesondere Verbindungen wie Natriumchlorid, Kaliumchlorid oder Calciumcarbonat zum Einsatz.
In der Bauwirtschaft spielen Salze ebenfalls eine zentrale Rolle. Calciumsulfat, auch bekannt als Gips, wird zur Herstellung von Baustoffen wie Gipsplatten und Putz verwendet. Weiterhin findet man Magnesiumsulfat in der Betonproduktion, um die Festigkeit zu erhöhen.
Auch in der Lebensmittelindustrie sind Salze unverzichtbar. Natriumchlorid, besser bekannt als Speisesalz, ist ein grundlegendes Gewürz und Konservierungsmittel und wird in großen Mengen benötigt. Darüber hinaus kommen Salze in der Wasseraufbereitung zum Einsatz. Sie helfen dabei, Wasser zu enthärten und damit Anlagen und Maschinen vor Verkalkung zu schützen.
Nicht zuletzt haben Salze im medizinischen Bereich ihre Verwendung. Beispielsweise wird Natriumhydrogencarbonat bei der Regulation des Säure-Basen-Haushaltes eingesetzt. Die umfassende Anwendung von Salzen zeigt deren enormen Stellenwert innerhalb verschiedener Industriezweige.