Welche Eigenschaften haben Salze?
Salze sind eine faszinierende Klasse von Verbindungen, die durch ihre vielfältigen chemischen und physikalischen Eigenschaften hervorstechen. Typischerweise bestehen Salze aus Metall- und Nichtmetallionen, die in einer geordneten Kristallstruktur angeordnet sind. Diese ionische Bindung verleiht ihnen eine bemerkenswerte Stabilität und führt zu hohen Schmelz- und Siedepunkten. Ein weiteres charakteristisches Merkmal ist ihre spröde Festigkeit, die sie hart, aber leicht brechbar macht.
In ihrem festen Zustand wirken Salze als Isolatoren und leiten keinen Strom. Werden sie jedoch geschmolzen oder in Wasser gelöst, zeigen sie gute elektrische Leitfähigkeit dank ihrer Elektrolyteigenschaften. Viele Salze sind zudem hydrophil und lösen sich gut in Wasser, wobei sich ihre Löslichkeit je nach Ionengröße unterscheidet. Einige Salze können auch hygroskopisch sein und Feuchtigkeit aus der Luft aufnehmen. In reinem Zustand sind die meisten Salze farblos, obwohl sie bei Erhitzen oft eine charakteristische Flammenfärbung zeigen.
Bemerkenswert ist auch ihre Reaktionsfähigkeit mit Säuren und Basen, was sie zu wertvollen Stoffen in zahlreichen chemischen Anwendungen macht. Es sollte jedoch beachtet werden, dass einige Salze toxisch sein können und sorgfältig gehandhabt werden müssen. Ihre spezifische Dichte und Gitterenergie variieren je nach der Art der Ionen und der Struktur des Salzes.
Das Wichtigste in Kürze
- Salze bestehen aus Metall- und Nichtmetallionen in geordneten Kristallstrukturen.
- Im festen Zustand sind Salze Isolatoren, aber leitfähig in Lösung.
- Hohe Schmelzpunkte und spröde Festigkeit kennzeichnen Salze.
- Löslichkeit von Salzen variiert mit Ionengröße und Gitterenergie.
- Viele Salze sind hydrophil, teilweise toxisch und zeigen Flammenfärbung.
Salze bestehen aus positiv geladenen Metallionen und negativ geladenen Nichtmetallionen. Sie bilden regelmäßige Kristallstrukturen und haben hohe Schmelz- und Siedepunkte. Salze sind in der Regel spröde und leiten in geschmolzenem Zustand oder in Lösung den elektrischen Strom.
Kristalline Struktur durch regelmäßiges Ionengitter
In der Chemie sind Salze für ihre charakteristische Kristallstruktur bekannt, die durch ein regelmäßiges Ionengitter gebildet wird. Diese Struktur entsteht aufgrund der starken elektrostatischen Anziehungskräfte zwischen den positiv und negativ geladenen Ionen. Je nach Art der beteiligten Ionen können sich unterschiedliche Gitterstrukturen bilden, wie beispielsweise kubisch oder hexagonal angeordnete Systeme.
Die Ordnung im Kristallgitter führt dazu, dass Salze oft klare und definierte Formen annehmen. Dies zeigt sich etwa bei Kochsalz (Natriumchlorid), das typischerweise in würfelförmigen Kristallen vorkommt. Die regelmäßige Anordnung der Ionen trägt maßgeblich zur hohen Schmelz- und Siedepunkt von Salzen bei – es erfordert eine beträchtliche Menge Energie, um die Ionen aus ihrer festen Position im Gitter zu lösen.
Ein weiterer interessanter Aspekt der kristallinen Struktur ist deren Beitrag zur spröde Festigkeit von Salzen. Wenn Druck auf einen Kristall ausgeübt wird, verschieben sich die Ionenreihen minimal, was sofort zu einem Bruch entlang spezifischer Ebenen führt. Aus diesem Grund lassen sich Salzkristalle leicht zerkleinern, ohne dabei plastisch zu verformen.
Neben diesen physischen Eigenschaften beeinflusst die regelmäßige Anordnung der Ionen auch die verschiedenen Elektrolyteigenschaften von Salzen. So haben sie in wässriger Lösung eine gute elektrische Leitfähigkeit, da die Ionen frei beweglich sind. Dagegen fungieren die gleichen Salze im festen Zustand als Isolatoren, weil die Ionen fest im Gitter eingebunden sind.
Diese einzigartigen Eigenschaften machen Salze nicht nur in wissenschaftlichen Anwendungen unverzichtbar, sondern spielen auch im täglichen Leben eine bedeutende Rolle.
„In der Natur gibt es einen vollkommeneren Kristall als den des Natriumchlorids.“ – Justus von Liebig
| Eigenschaft | Beschreibung |
|---|---|
| Kristallstruktur | Geordnetes Ionengitter, typischerweise kubisch oder hexagonal |
| Hohe Schmelzpunkte | Erfordert viel Energie, um die Ionen aus dem Gitter zu lösen |
| Ionenbindung | Starke elektrostatische Anziehungskräfte zwischen positiv und negativ geladenen Ionen |
| Löslichkeit in Wasser | Viele Salze sind hydrophil und lösen sich gut in Wasser |
| Elektrische Leitfähigkeit in Schmelze | Zeigen gute Leitfähigkeit, da Ionen frei beweglich sind |
| Elektrolyteigenschaften | Steigern die Leitfähigkeit von wässrigen Lösungen |
| Spröde Festigkeit | Hart, aber leicht brechbar unter Druck |
| Gitterenergie | Trägt zur Stabilität des Ionengitters bei |
| Hydrophil | Neigung, Feuchtigkeit aus der Luft aufzunehmen |
| Farblosigkeit in reinem Zustand | Oft farblos, aber kann charakteristische Flammenfärbung zeigen |
| Reaktionsfähigkeit mit Säuren und Basen | Spielen eine wichtige Rolle in chemischen Reaktionen |
| Isolatoren im festen Zustand | Leiten keinen Strom, da Ionen fest im Gitter eingebunden sind |
| Gute Leitfähigkeit in wässriger Lösung | Ionen sind frei beweglich und leiten Strom effizient |
| Oft hygroskopisch | Können Feuchtigkeit aus der Umgebung aufnehmen |
| Teilweise toxisch | Können gesundheitsschädlich sein und erfordern Vorsicht |
| Spezifische Dichte | Variiert je nach Art der Ionen und der Struktur des Salzes |
| Charakteristische Flammenfärbung | Zeigen bei Erhitzung typische Farben |
Hoher Schmelz- und Siedepunkt
Salze zeichnen sich durch ihre hohen Schmelz- und Siedepunkte aus, was hauptsächlich auf die starke Bindung zwischen den Ionen im Kristallgitter zurückzuführen ist. Diese Ionenbindung erfordert erhebliche Mengen an Energie, um die Stabilität des Ionengitters zu überwinden und die feste Struktur in einen flüssigen oder gasförmigen Zustand zu überführen.
Da die kristalline Struktur von Salzen aus regelmäßig angeordneten Kationen und Anionen besteht, erhöht dies zusätzlich die Gitterenergie, die zur Stabilität des Systems beiträgt. Beispielsweise hat Natriumchlorid (Tafelsalz) einen sehr hohen Schmelz- und Siedepunkt, weil die elektrostatische Anziehungskraft zwischen dem positiv geladenen Natriumion und dem negativ geladenen Chloridion besonders stark ist.
Die hohe Gitterenergie der Salze erklärt somit auch ihre typische spröde Festigkeit. Beim Versuch, das Kristallgitter zu verformen, brechen oft ganze Schichten aufgrund der starken Coulomb-Kräfte auseinander.
Zusätzlich besitzen viele Salze die Eigenschaft, in Wasser gut löslich (hydrophil) zu sein, da das Lösungsmittel die Gitterstruktur destabilisiert und die einzelnen Ionen umhüllt. Die Löslichkeit in Wasser fördert gleichzeitig ihre Verwendung als Elektrolyte, was bedeutet, dass sie elektrische Leitfähigkeit in wässriger Lösung ermöglichen.
In fester Form sind Salze hingegen Isolatoren, was darauf zurückzuführen ist, dass die Ionen in ihrem festen Gitter immobilisiert sind und nicht zur elektrischen Leitung beitragen können. Erst in der geschmolzenen Form oder in einer wässrigen Lösung entfalten sie ihre ausgezeichnete elektrische Leitfähigkeit.
Gute elektrische Leitfähigkeit in Lösung
Salze zeichnen sich durch ihre gute elektrische Leitfähigkeit in Lösung aus. Dies ist darauf zurückzuführen, dass die Ionenbindung der Salze in wässriger Lösung aufgebrochen wird und die einzelnen Ionen von Wassermolekülen umgeben werden. Diese freibeweglichen Ionen sind verantwortlich für die elektrische Leitfähigkeit.
Wenn ein Salz wie Natriumchlorid (Kochsalz) in Wasser gelöst wird, dissoziiert es in seine Bestandteile: Na+ und Cl–. In diesem Zustand können die Ionen frei im Wasser migrieren und ermöglichen so den Stromfluss. Daher funktionieren lösliche Salze häufig als Elektrolyte, was sie für viele Anwendungen in Chemie und Physik interessant macht.
Im festen Zustand hingegen fungieren Salze typischerweise als Isolatoren, da die Ionen in einem festgefügten Gitter gebunden sind und sich nicht frei bewegen können. Erst in der Schmelze oder Lösung zeigen sie ihre Leitfähigkeit.
Die Elektrolyteigenschaften von Salzen sind besonders nützlich in verschiedenen technischen und biologischen Systemen. Beispielsweise spielen Salze eine wichtige Rolle in Batterien, wo sie als leitfähige Medien dienen. Auch im menschlichen Körper sind diese Eigenschaften unerlässlich, denn viele biologische Prozesse beruhen auf der Bewegung von Ionen durch Zellmembranen.
Insgesamt illustriert die gute elektrische Leitfähigkeit von Salzen in Lösung eindrucksvoll, wie chemische Eigenschaften praktische Anwendungen ermöglichen.
Typisch hart und spröde
Die physikalischen Eigenschaften von Salzen sind vielfältig und faszinierend. Ein besonders auffälliges Merkmal ist ihre typische Härte und Sprödigkeit. Diese Eigenschaften lassen sich durch die strukturellen Merkmale und die Bindungskräfte in den Salzen erklären.
Salze zeichnen sich durch eine regelmäßige kristalline Struktur aus, die als Ionengitter bezeichnet wird. In diesem Gitter sind positiv und negativ geladene Ionen abwechselnd in einer festen Anordnung platziert. Die starken elektrostatischen Kräfte zwischen diesen entgegengesetzt geladenen Ionen führen zu einer sehr stabilen Verbindung. Diese Stabilität verleiht Salzen ihre charakteristische Härte.
Jedoch bedeutet die stark geordnete Kristallstruktur auch, dass Salze spröde sind. Bei mechanischer Belastung, wie etwa einem Schlag oder Druck, verschieben sich die Schichten der Ionen. Dabei treffen gleichgeladene Ionen aufeinander und stoßen sich ab, was zum Bruch des Ionenkristalls führt. Dieser Prozess erklärt, warum Salze zwar hart, aber nicht flexibel oder dehnbar sind.
Ein weiteres interessantes Phänomen ist die Löslichkeit in Wasser, die im Wesentlichen davon abhängt, wie gut das Ionengitter aufgebrochen werden kann. Dies zeigt deutlich, dass die Gitterenergie, also die Energie, die benötigt wird, um die Ionen aus ihrem Gitterverband zu lösen, eine entscheidende Rolle spielt.
Zusammenfassend lässt sich sagen, dass die typische Härte und Sprödigkeit von Salzen bedeutende physikalische Eigenschaften sind, die eng mit ihrer kristallinen Struktur und den darin wirkenden Ionenbindungen verknüpft sind.
Löslichkeit variiert mit Ionengröße
Die Löslichkeit von Salzen in Wasser hängt stark von der Größe ihrer Ionen ab. Kleinere Ionen sind tendenziell stärker löslich, da sie durch das Lösungsmittel leichter umgeben und stabilisiert werden können. Gleichzeitig nimmt bei größeren Ionen die Löslichkeit oft ab, weil diese weniger effizient hydratisieren.
Ein bekanntes Beispiel für diese Beziehung zwischen Ionengröße und Löslichkeit ist bei Halogenidsalzen zu beobachten. Während Natriumchlorid (NaCl) im Wasser gut löslich ist, zeigt Silberchlorid (AgCl) eine deutlich geringere Löslichkeit aufgrund der unterschiedlichen Iongrößen und deren Wechselwirkungen mit dem Wasser.
Es gibt jedoch weitere Faktoren, die hier eine Rolle spielen. Zum Beispiel beeinflusst auch die Gitterenergie eines Salzes dessen Löslichkeit. Starke Ionenbindungen innerhalb des Kristallgitters müssen aufgebrochen werden, um die Ionen in Lösung zu bringen. Dies ist energetisch kostspielig und kann die gesamte Löslichkeit verringern.
Zusammenfassend lässt sich sagen, dass die Wechselwirkung zwischen Ionengröße, Gitterenergie und den hydratisierenden Eigenschaften des Lösungsmittels entscheidend für die Löslichkeit eines Salzes ist. Darüber hinaus spielt auch die spezifische Dichte der Ionenverbindung einen Einfluss auf die einzelnen Lösungsprozesse.
| Eigenschaft | Beispiel | Bemerkung |
|---|---|---|
| Kristallstruktur | Natriumchlorid | Würfelförmige Kristalle |
| Hohe Schmelzpunkte | Calciumfluorid | Hoher Schmelzpunkt etwa 1418°C |
| Reaktionsfähigkeit mit Säuren | Calciumsulfat | Reagiert mit Säuren zu Gips |
Meist aus Metall- und Nichtmetallionen
Typischerweise werden Salze aus einer Kombination von Metall- und Nichtmetallionen gebildet. Diese Ionen ordnen sich in einem regelmäßigen Kristallgitter an, wodurch die stabile Struktur des Salzes entsteht.
Die Einfachheit der chemischen Zusammensetzung trägt zu den charakteristischen physikalischen Eigenschaften bei. Zum einen fungieren Metal-Ionen als Kationen, während die Nichtmetallionen Anionen darstellen. Die Ionenbindung zwischen diesen unterschiedlichen Arten von Ionen führt zu einer starken elektrostatischen Anziehungskraft.
Eine weitere wichtige Eigenschaft ist die Gitterenergie, die maßgeblich dazu beiträgt, die hohen Schmelz- und Siedepunkte von Salzen zu erklären. Salze zeigen nicht nur eine bemerkenswerte Stabilität, sondern sind auch typischerweise hydrophil. Deshalb lösen sie sich oft gut in Wasser auf und übernehmen die Rolle von starken Elektrolyten, wenn sie gelöst oder geschmolzen sind.
In ihrem reinen Zustand sind viele Salze farblos, obwohl einige aufgrund von Verunreinigungen oder spezifischen Ionen Farben aufweisen können. Trotz ihrer spröden Festigkeit werden Salze gerne in verschiedenen Industrien verwendet, einschließlich Medizin und Herstellung, da sie oft hygroskopisch und reaktionsfähig mit Säuren und Basen sind. Insgesamt zeigt ihre einfache Zusammensetzung eine große Bandbreite an Anwendungen und wichtigen physikalischen Eigenschaften.
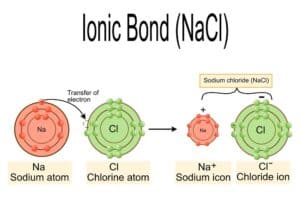
Ionische Bindungen für Stabilität
Ionische Bindungen sind entscheidend für die Stabilität von Salzen. Diese Art der chemischen Verbindung entsteht durch die elektrostatische Anziehung zwischen positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen).
Eine wichtige Eigenschaft ist ihre hohe Gitterenergie, die die Stabilität des Ionengitters gewährleistet. Die Gitterenergie ist ein Maß für die Stärke der elektrostatischen Kräfte, die die Ionen zusammenhalten. Dank dieser starken Anziehungskräfte besitzen viele Salze hohe Schmelzpunkte und Siedepunkte, was sie besonders widerstandsfähig macht.
Darüber hinaus zeigen ionische Verbindungen charakteristische physikalische Eigenschaften, wie die spröde Festigkeit. Ein typisches Beispiel eines Salzkristalls stellt Natriumchlorid dar, das in seiner festen Form ein Isolator ist, aber bei einer Temperaturerhöhung schmilzt und leitfähig wird. Dies liegt daran, dass in der flüssigen Phase oder gelöst in Wasser, sich die Ionen frei bewegen können, was zu einer guten elektrischen Leitfähigkeit führt.
Das Wissen um die spezifische Dichte von Salzen unterstützt auch deren Identifikation und Nutzung in verschiedenen Anwendungen. Solche Stoffe reagieren leicht mit Säuren und Basen, und diese Reaktionsfähigkeit kann zur Herstellung neuer Verbindungen genutzt werden. Es ist ebenfalls bemerkenswert, dass viele Salze hydrophil sind und daher oft hygroskopisch wirken, das bedeutet, sie ziehen Feuchtigkeit aus der Umgebung an.
Viele Salze erscheinen im reinen Zustand farblos, aber einige verursachen eine charakteristische Flammenfärbung aufgrund der Lichtemission ihrer Ionen, wenn sie erhitzt werden.
Neutralisation von Säuren und Basen
Salze haben eine bemerkenswerte Fähigkeit, sowohl Säuren als auch Basen zu neutralisieren. Diese Eigenschaft ist vor allem in der Chemie und in verschiedenen industriellen Prozessen von großem Interesse.
Bei der Neutralisation reagieren die hydrophilen Ionen des Salzes mit den Wasserstoffionen der Säure oder den Hydroxidionen der Base und bilden dabei Wasser sowie ein neues Salz. Dies bedeutet, dass Salze oft verwendet werden, um die pH-Werte verschiedener Lösungen zu regulieren.
Ein Beispiel ist die Reaktion zwischen Natriumhydroxid (NaOH) und Salzsäure (HCl), wobei das entstehende Produkt Natriumchlorid (NaCl) und Wasser (H₂O) ist. Das Ergebnis dieser Reaktion zeigt die typische Farblosigkeit in reinem Zustand, wie sie für viele Salze charakteristisch ist.
Salze spielen auch bei biologischen Prozessen eine wichtige Rolle. So kann zum Beispiel Natriumbicarbonat im menschlichen Körper helfen, überschüssige Magensäure zu neutralisieren. Darüber hinaus sind Salze in der pharmazeutischen Industrie nützlich, da ihre neutralisierende Wirkung Sicherheit und Effektivität vieler Medikamente unterstützt.
Die elektrolyteigenschaften vieler Salze machen sie zu idealen Kandidaten für diese Anwendungen, indem sie eine hohe elektrische Leitfähigkeit in wässriger Lösung aufweisen. Durch Ihre Löslichkeit in Wasser können Salze effizient genutzt werden, um unerwünschte chemische Verbindungen zu deaktivieren.
Salze haben durch ihr Verhalten nicht nur wissenschaftliche, sondern auch praktische Relevanz und tragen so vielfach zur Verbesserung von Produkten und Prozessen bei.