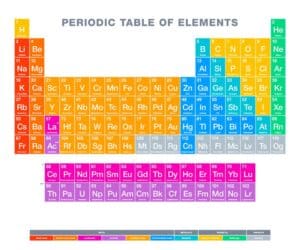
Das Periodensystem der Elemente ist ein fundamentales Werkzeug in der Chemie. Eine zentrale Komponente dabei ist die Ordnungszahl. Diese definiert die Anzahl der Protonen im Atomkern eines Elements und bestimmt die Position jedes Elements im Periodensystem. Da sie von links nach rechts in den Perioden ansteigt, beeinflusst die Ordnungszahl maßgeblich die chemischen Eigenschaften und die Reaktivität der Elemente.
Das Wichtigste in Kürze
- Die Ordnungszahl definiert die Anzahl der Protonen im Atomkern eines Elements.
- Sie bestimmt die Position der Elemente im Periodensystem und ihre chemischen Eigenschaften.
- Ordnungszahlen steigen von links nach rechts in Perioden und erhöhen die Reaktivität.
- Ordnungszahlen ermöglichen die Klassifikation der Elemente in Gruppen und Perioden.
- Die chemische Reaktivität und Elektronenkonfiguration hängen von der Ordnungszahl ab.
Ordnungszahl definiert Anzahl der Protonen im Atomkern
Die Ordnungszahl eines Elements im Periodensystem ist von zentraler Bedeutung, da sie die Anzahl der Protonen im Atomkern dieses Elements angibt. Die Protonenzahl ist einzigartig für jedes Element und bestimmt dessen chemische Eigenschaften. Wenn Sie sich beispielsweise Wasserstoff ansehen, das erste Element im Periodensystem, hat es eine Ordnungszahl von 1, was bedeutet, dass ein Wasserstoffatom genau ein Proton in seinem Kern hat.
Wenn man die höhere Ordnungszahl von Helium betrachtet, die 2 beträgt, erkennt man, dass Helium zwei Protonen im Atomkern besitzt. Dieser Unterschied scheint klein, führt jedoch zu komplett anderen chemischen Verhalten im Vergleich zu Wasserstoff.
Jedes Element erhält seine Position im Periodensystem anhand seiner Ordnungszahl. Daher bewegt sich die Reihenfolge natürlich von links nach rechts durch die Perioden des Periodensystems, wobei die Ordnungszahlen stetig ansteigen.
Durch diesen geordneten Aufbau ermöglicht das Periodensystem nicht nur einen schnellen Überblick über die Elemente, sondern auch Rückschlüsse auf ihre Reaktivität und Bindungseigenschaften.
Insgesamt lässt sich feststellen, dass die Ordnungszahl als Grundlage dient, um die verschiedenen Elemente im Periodensystem logisch zu platzieren und deren Eigenschaften präzise zu beschreiben.
Die Anordnung im Periodensystem enthüllt die Ordnung im Aufbau der Elemente und zeigt die Beziehungen zwischen ihnen. – Dmitri Iwanowitsch Mendelejew
| Element | Ordnungszahl |
|---|---|
| Wasserstoff | 1 |
| Helium | 2 |
| Kohlenstoff | 6 |
| Sauerstoff | 8 |
| Eisen | 26 |
Bestimmt die Position der Elemente im Periodensystem
Die Ordnungszahl bestimmt die Position der Elemente im Periodensystem. Jedes Element ist durch seine einzigartige Anzahl an Protonen definiert, was seine spezifische Ordnungszahl darstellt. Diese Zahl steigt von links nach rechts innerhalb einer Periode des Periodensystems und beeinflusst wesentlich die Platzierung der Elemente.
Es gibt insgesamt sieben Perioden im Periodensystem, wobei jede Periode eine neue Zeile im Diagramm beginnt und verschiedene chemische Eigenschaften aufweist. Die Spalten im Periodensystem werden als Gruppen bezeichnet und enthalten Elemente mit ähnlichen chemischen Charakteristika. Dies liegt daran, dass sie ähnliche Elektronenkonfigurationen haben.
Elemente in derselben Gruppe, wie die Edelgase oder Halogene, teilen oft viele physikalische und chemische Eigenschaften. Beispielsweise sind alle Edelgase nichtmetallisch und sehr reaktionsträge, während die Alkalimetalle hochreaktiv sind.
Die fortschreitende Zunahme der Ordnungszahlen von einem Element zum nächsten spiegelt sich in deren zunehmender Komplexität wider. Dadurch können Wissenschaftler Vorhersagen über die Eigenschaften von unbekannten oder neu entdeckten Elementen treffen, basierend auf ihrer Position im Periodensystem.
Durch diese systematische Anordnung der Elemente wird die Chemie übersichtlicher und zugänglicher für Forschung und Lehre.
| Element | Ordnungszahl | Kategorie |
|---|---|---|
| Neon | 10 | Edelgas |
| Natrium | 11 | Alkalimetall |
| Gold | 79 | Übergangsmetall |
| Silicium | 14 | Halbmetall |
| Phosphor | 15 | Nichtmetall |
Steigt von links nach rechts in Perioden
Im Periodensystem verändert sich die Ordnungszahl systematisch. Das bedeutet, sie steigt von links nach rechts in den Perioden. Jede Periode beginnt mit einem Element, das eine relativ geringe Ordnungszahl hat und endet mit einem viel höheren Wert.
Das Hinzufügen eines zusätzlichen Protons im Atomkern bewirkt, dass die Ordnungszahlen linear ansteigen. Dieser geordnete Anstieg ist ein Grundprinzip des Periodensystems. Deshalb sind Elemente mit ähnlichen chemischen Eigenschaften in vertikalen Gruppen zusammengefasst.
Die Veränderung der Ordnungszahl beeinflusst nicht nur die Anzahl der Protonen, sondern oft auch die Elektronenkonfiguration der Atome. Dies spielt eine wichtige Rolle bei den chemischen Eigenschaften der Elemente. Aus diesem Grund kann man vorhersehen, wie ein Element in einer chemischen Reaktion reagiert, basierend auf seiner Position im Periodensystem.
Wenn Sie beispielsweise Natrium (Ordnungszahl 11) betrachten, folgt ihm Magnesium mit Ordnungszahl 12, Aluminium mit 13, und so weiter – bis hin zu den Edelgasen am Ende jeder Periode.
Dieses System ermöglicht es Wissenschaftlern und Chemikern, effizient zu arbeiten, da sie durch das Verständnis der Ordnungszahlen viel über die Elemente ableiten können.
Video: Ordnungszahl erklärt im Periodensystem der Elemente
Video-Link: https://www.youtube.com/watch?v=NrAdIKIHTVQ
Beeinflusst chemische Eigenschaften und Reaktivität
Der Einfluss der Ordnungszahl auf die chemischen Eigenschaften und die Reaktivität eines Elements ist entscheidend. Die Ordnungszahl gibt an, wie viele Protonen sich im Atomkern eines Elements befinden. Diese Information bestimmt sowohl die elektronische Konfiguration eines Atoms als auch seine Platzierung im Periodensystem.
Elektronenverteilung um den Atomkern beeinflusst direkt, wie das Element reagiert und mit welchen anderen Stoffen es Verbindungen eingehen kann. Beispielsweise haben Elemente derselben Gruppe ähnliche chemische Eigenschaften, weil sie dieselbe Anzahl von Valenzelektronen besitzen.
Ein weiteres Beispiel für die Bedeutung der Ordnungszahl ist das Verhalten der Edelgase. Aufgrund ihrer spezifischen elektronenkonfiguration reagieren sie kaum oder gar nicht mit anderen Elementen. Das Verständnis der Ordnungszahl hilft also dabei, chemische Reaktionen vorherzusagen.
Zusätzlich ermöglicht uns die Kenntnis der Ordnungszahl ein tieferes Verständnis der Trends im Periodensystem, wie z.B. Ionisierungsenergie und Elektronegativität. So zeigt die steigende Ordnungszahl innerhalb einer Periode meist eine zunehmende Ionisierungsenergie, was bedeutet, dass mehr Energie benötigt wird, um ein Elektron zu entfernen.
Insgesamt liefert die Ordnungszahl eine wesentliche Grundlage, um das komplexe Verhalten von Elementen in verschiedenen chemischen Prozessen nachvollziehen zu können.
Video: Ordnungszahl – Massenzahl – Isotop | Atomphysik | Lehrerschmidt
Video-Link: https://www.youtube.com/watch?v=ArQg10JHyQw&t=87s
Grundlage für Elementklassifikation nach Gruppen und Perioden
Das Periodensystem der Elemente ist eine fundamentale Basis für die Wissenschaft der Chemie. Grundlage für seine Struktur ist vor allem die Ordnungszahl, welche die Anzahl der Protonen im Atomkern eines Elements darstellt. Diese Zahl beeinflusst nicht nur die chemischen Eigenschaften und die Reaktivität des jeweiligen Elements, sondern bestimmt auch seine Position im Periodensystem.
Dank der Ordnungszahl können Elemente präzise nach Gruppen und Perioden eingeordnet werden. Eine Gruppe stellt hierbei eine vertikale Spalte im Periodensystem dar, in der sich Elemente mit ähnlichen chemischen Eigenschaften befinden. Dies liegt daran, dass sie gleiche Elektronenkonfigurationen in ihren äußeren Schalen aufweisen. Eine Periode ist hingegen eine horizontale Reihe, die anzeigt, wie viele Elektronenschalen die Atome der Elemente haben.
Die Klassifikation ist entscheidend, da sie es ermöglicht, systematisch Vorhersagen über das Verhalten von Elementen zu treffen und ihre Interaktionen zu verstehen. Durch die Anordnung nach Ordnungszahlen erhalten Forschende ein Werkzeug, um chemische Reaktionen zu analysieren und neue Verbindungen zu entdecken.
Kurz gesagt, das Verständnis der Ordnungszahl und ihrer Anwendung im Periodensystem bildet die essentielle Grundlage für die moderne Chemie und deren unzählige Anwendungen.
Wichtiger Indikator für atomare Struktur und Verhalten
Die Ordnungszahl ist ein wichtiger Indikator für die atomare Struktur und das Verhalten der Elemente im Periodensystem. Sie gibt die Anzahl der Protonen im Kern eines Atoms an, was wiederum über die Identität des Elements entscheidet.
Diese Zahl beeinflusst maßgeblich die chemischen Eigenschaften und die Reaktivität eines Elements. Zum Beispiel hat Wasserstoff die Ordnungszahl 1, da es nur ein Proton besitzt, während Helium zwei Protonen und damit die Ordnungszahl 2 hat.
Analog zur Position in einer bestimmten Gruppe oder Periode des Periodensystems, bestimmt die Ordnungszahl auch, wie sich ein Element in chemischen Reaktionen verhält und mit welchen anderen Elementen es am ehesten interagiert. Ein Verständnis dieser Ordnungsthematik erlaubt Rückschlüsse auf die elektronische Konfiguration eines Atoms. Das heißt, welche Elektronenschalen besetzt sind und wie diese Elektronen angeordnet sind.
Zusätzlich reflektiert die Ordnungszahl auch den Aufbau eines Elements, von seiner einfachsten bis hin zu komplexeren Formen. Dank dieser Kennziffer ist es möglich, systematisch und vorausschauend chemische Verbindungen und deren Charakteristika zu bestimmen.
In wissenschaftlichen Feldern wie Chemie und Physik ist die Kenntnis der Ordnungszahl grundlegend für das Studium der Materie und deren Interaktion.