Wertigkeit bestimmen
Die Wertigkeit eines Atoms beschreibt die Anzahl der Bindungen, die es eingehen kann. Sie ist ein grundlegendes Konzept in der Chemie und spielt eine zentrale Rolle bei der Bildung von Verbindungen. Die Bindungsmöglichkeiten von Atomen hängen von den Valenzelektronen ab, welche sich in der äußersten Elektronenschale befinden.
Im Periodensystem der Elemente lassen sich die Wertigkeiten oft gut ablesen, insbesondere bei den Hauptgruppen. Verschiedene Elemente weisen unterschiedliche Wertigkeiten auf, was zu vielfältigen chemischen Verbindungen führt. Einige einfache Regeln helfen dabei, die Wertigkeit zu bestimmen, doch gibt es auch Ausnahmen, besonders bei Übergangsmetallen.
Die Wertigkeit ein grundlegendes Konzept in der Chemie ist und das Verständnis derer wichtig ist, um die chemischen Eigenschaften von Elementen und Verbindungen zu verstehen.
Dieses Verständnis ermöglicht es, die Struktur von Molekülen und deren Reaktionsfähigkeit vorherzusagen. Die Kenntnis über Wertigkeiten ist nicht nur für theoretische Überlegungen wichtig, sondern hat praktische Anwendungen im Alltag und in der Industrie.
Das Wichtigste in Kürze
- Wertigkeit beschreibt die Anzahl der Bindungen, die ein Atom eingehen kann.
- Valenzelektronen in der äußeren Schale bestimmen die Wertigkeit.
- Elemente der Hauptgruppen haben regelmäßigere Wertigkeiten; Übergangsmetalle variable.
- Kovalenzen oder Ionenbindungen bilden stabile Moleküle und Verbindungen.
- Wertigkeit ist entscheidend für Molekülstrukturen und chemische Reaktionen.
In der Chemie bezeichnet „Wertigkeit“ die Anzahl der Bindungen, die ein Atom in einer Verbindung eingehen kann. Sie wird auch als „Oxidationszahl“ bezeichnet und gibt an, wie viele Elektronen ein Atom aufnimmt oder abgibt, um eine stabile Verbindung zu bilden. Die Wertigkeit eines Elements kann variieren, abhängig von den Bedingungen und der Art der Verbindung, in der es sich befindet.
Definition der Wertigkeit in der Chemie
In der Chemie bezeichnet die Wertigkeit eines Atoms die Anzahl an Bindungen, die es eingehen kann, um stabile Moleküle oder Verbindungen zu bilden. Diese Fähigkeit eines Atoms, andere Atome zu binden, basiert auf der Anzahl seiner Valenzelektronen, also den Elektronen in der äußersten Schale.
Die Valenzelektronen spielen eine entscheidende Rolle bei der Bestimmung der Wertigkeit, da sie direkt an den chemischen Bindungen beteiligt sind. Die Position eines Elements im Periodensystem gibt Hinweise auf seine Wertigkeit, insbesondere für Elemente der Hauptgruppen. Zum Beispiel haben Elemente der ersten Hauptgruppe meist eine Wertigkeit von eins, während Elemente der zweiten Hauptgruppe typischerweise eine Wertigkeit von zwei besitzen.
Es ist wichtig zu beachten, dass die Regelmäßigkeiten der Wertigkeit nicht immer starr sind und Ausnahmen auftreten können, besonders bei Übergangsmetallen. Diese Metalle zeigen häufig variable Wertigkeiten aufgrund ihrer komplexen Elektronenkonfigurationen. So können Eisen (Fe) beispielsweise sowohl eine Wertigkeit von zwei als auch von drei haben.
Abschließend lässt sich festhalten, dass die Kenntnis über die Wertigkeit eines Elements und die Fähigkeit, die Wertigkeit im Periodensystem abzulesen, essenziell für das Verständnis von chemischen Reaktionen und der Bildung neuer Verbindungen ist.
Chemie ist die Erforschung der Reaktionen der Wertigkeiten von Atomen und Molekülen. – Linus Pauling
| Element | Wertigkeit |
|---|---|
| Wasserstoff (H) | 1 |
| Sauerstoff (O) | 2 |
| Kohlenstoff (C) | 4 |
| Eisen (Fe) | 2, 3 |
| Natrium (Na) | 1 |
| Chlor (Cl) | 1, 3, 5, 7 |
Wo steht die Wertigkeit im Periodensystem der Elemente?
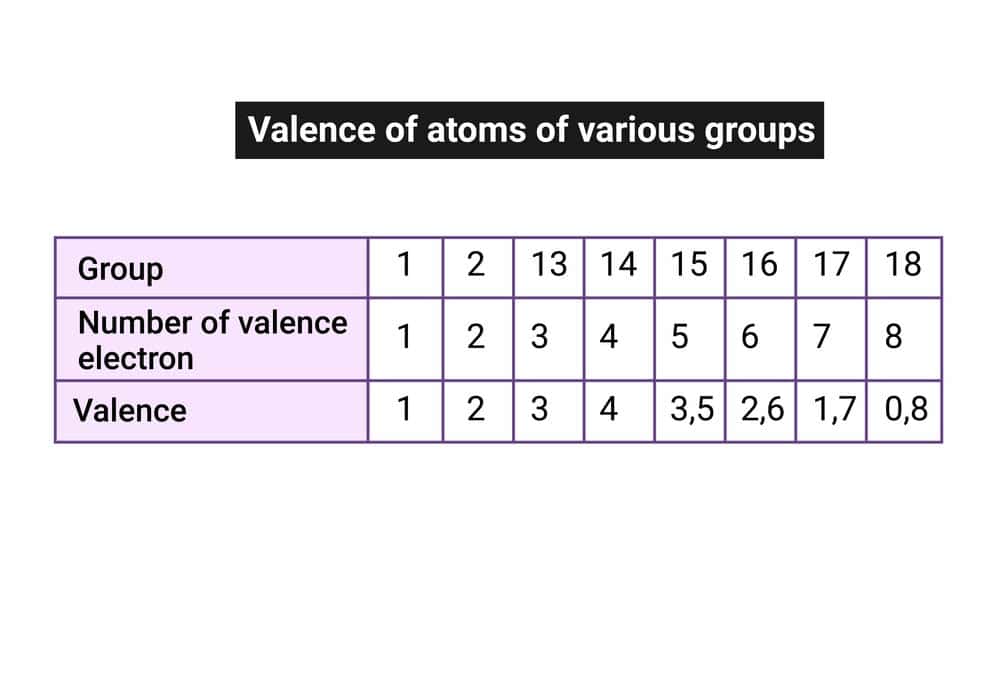
Die Wertigkeit eines Elements im Periodensystem zeigt an, wie viele Bindungen ein Atom dieses Elements in einer Verbindung eingehen kann. Die Wertigkeit eines Elements kann anhand seiner Gruppennummer im Periodensystem bestimmt werden. In der Regel entspricht die Wertigkeit der Hauptgruppennummer des Elements.
Zum Beispiel haben die Elemente der 1. Hauptgruppe eine Wertigkeit von 1, die Elemente der 2. Hauptgruppe eine Wertigkeit von 2 und so weiter.
- Sauerstoff: Die Wertigkeit von Sauerstoff beträgt in der Regel 2.
- Kohlenstoff: Die Wertigkeit von Kohlenstoff beträgt in der Regel 4.
- Stickstoff: Die Wertigkeit von Stickstoff beträgt in der Regel 3.
- Chlor: Die Wertigkeit von Chlor beträgt in der Regel 1.
- Wasserstoff: Die Wertigkeit von Wasserstoff beträgt in der Regel 1.
Wertigkeit Chemie einfach erklärt
In der Chemie bezeichnet die Wertigkeit eines Elements die Anzahl der Bindungen, die ein Atom dieses Elements in einer Verbindung eingehen kann. Die Wertigkeit hilft uns zu verstehen, wie sich Atome verhalten, wenn sie sich zu Molekülen verbinden. Sie gibt an, wie viele Elektronen ein Atom aufnehmen oder abgeben muss, um eine stabile Verbindung zu bilden.
Die Wertigkeit eines Elements kann anhand seiner Position im Periodensystem bestimmt werden. In den Hauptgruppen des Periodensystems entspricht die Wertigkeit oft der Nummer der Hauptgruppe, in der sich das Element befindet. Zum Beispiel haben Elemente der 1. Hauptgruppe eine Wertigkeit von 1, was bedeutet, dass sie eine Bindung eingehen und ein Elektron abgeben können.
Diese einfachen Konzepte helfen Schülern, die chemischen Eigenschaften und Reaktionen von Elementen besser zu erkennen, verstehen und zu erklären.
Wie kann man die Wertigkeit berechnen?
Die Berechnung der Wertigkeit eines Elements basiert in der Regel nicht auf einer spezifischen Formel, sondern eher auf der Kenntnis der Position des Elements im Periodensystem und der Gruppennummer, um die mögliche Anzahl der Bindungen zu bestimmen. Es ist daher keine spezielle mathematische Formel erforderlich, um die Wertigkeit eines Elements zu bestimmen. Es ist wichtig, die allgemeinen Regeln für die Wertigkeit im Periodensystem zu verstehen, um die Wertigkeit eines Elements korrekt bestimmen zu können.
Die Wertigkeit eines Elements kann anhand seiner Position im Periodensystem bestimmt werden. In den meisten Fällen entspricht die Wertigkeit der Hauptgruppennummer des Elements. Beispielsweise haben die Elemente der 1. Hauptgruppe eine Wertigkeit von 1, die Elemente der 2. Hauptgruppe eine Wertigkeit von 2 und so weiter.
Es gibt jedoch auch Ausnahmen, wie beispielsweise die Elemente der Hauptgruppen 3-12, bei denen die Wertigkeit variieren kann. Um die Wertigkeit eines Elements zu berechnen, ist es wichtig, die Hauptgruppennummer des Elements im Periodensystem zu kennen und zu verstehen, wie viele Bindungen das Element in einer Verbindung eingehen kann.
Bindungsmöglichkeiten von Atomen beschreiben
Atome können auf verschiedene Weise Bindungen eingehen, um stabile chemische Verbindungen zu bilden. Diese Bindungsmöglichkeiten hängen stark von der Anzahl an Valenzelektronen ab, also den Elektronen in der äußeren Schale eines Atoms.
Eine wichtige Rolle spielt hierbei die Elektronenkonfiguration. Elemente tendieren dazu, eine stabile Konfiguration zu erreichen, oft durch das Streben nach einer vollständigen Valenzschale, ähnlich wie bei den Edelgasen. Dies wird als Edelgaskonfiguration bezeichnet.
Es gibt mehrere Typen von chemischen Bindungen:
– Die Kovalente Bindung tritt auf, wenn zwei Atome ihre Valenzelektronen teilen. Dies führt zur Bildung von Molekülen.
– Die Ionische Bindung entsteht, wenn ein Atom Elektronen vollständig an ein anderes Atom abgibt, wodurch Ionen entstehen, die sich aufgrund entgegengesetzter Ladungen anziehen.
Ein weiteres Konzept ist die Bindungsordnung, die angibt, wie viele Bindungselektronen ein Paar Atome teilt. Eine höhere Bindungsordnung bedeutet typischerweise eine stärkere und kürzere Bindung.
Die sogenannte Bindigkeit eines Atoms beschreibt, wie viele kovalente Bindungen es eingehen kann. Diese hängt wiederum direkt mit den Valenzelektronen und deren Verteilung zusammen.
Wechselwirkungen zwischen Atomen werden auch durch deren Elektronegativität beeinflusst – ein Maß für die Tendenz eines Atoms, Bindungselektronen zu sich zu ziehen. All diese Aspekte ermöglichen eine breite Vielfalt an chemischen Verbindungen und beeinflussen deren Stabilität sowie Reaktivität.
Unterschiedliche Wertigkeiten verschiedener Elemente
Verschiedene Elemente haben unterschiedliche Wertigkeiten, da sie über variierende Zahlen an Valenzelektronen verfügen, die für chemische Bindungen entscheidend sind. Zum Beispiel hat das Wasserstoffatom nur ein Valenzelektron und daher eine Wertigkeit von 1. Kohlenstoff hingegen besitzt vier Valenzelektronen und kann somit vier Bindungen eingehen, was ihm eine Wertigkeit von 4 verleiht.
Elemente der Hauptgruppen im Periodensystem weisen regelmäßigere Muster in ihrer Bindungsfähigkeit auf. Die Edelgase in der Gruppe 18, wie Helium oder Neon, haben eine vollbesetzte Valenzschale und zeigen daher keine Reaktionsneigung – ihre Wertigkeit beträgt null.
Übergangsmetalle besitzen oft mehrere mögliche Oxidationszahlen, was ihre Wertigkeit flexibel gestaltet. Eisen kann beispielsweise als Fe²⁺ oder Fe³⁺ auftreten, je nach chemischer Umgebung. Dies verleiht diesen Metallen einzigartige Eigenschaften und macht sie besonders wertvoll in vielen industriellen Anwendungen.
Die Werte der Wertigkeit können außerdem angepasst werden, wenn sie kovalente Bindungen mit anderen Atomen eingehen, indem sie Elektronen teilen. Diese Flexibilität spielgelt sich auch in der Bindungsordnung wider, die beschreibt, wie viele Paare von Elektronen zwischen zwei Atomen existieren. All dies lässt sich durch eine genaue Betrachtung der Elektronenkonfiguration und der Position der Elemente im Periodensystem besser verstehen.
Regeln und Ausnahmen bei der Wertigkeit
In der Chemie gibt es bestimmte Regeln, die dabei helfen, die Wertigkeit eines Elements zu bestimmen. Eine grundlegende Regel ist, dass die Valenzelektronen (die Elektronen in der äußeren Schale eines Atoms) eine entscheidende Rolle spielen. Diese Valenzelektronen bestimmen, wie viele Bindungen ein Atom eingehen kann.
Ein Beispiel für diese Regel sind die Elemente der Hauptgruppe des Periodensystems. Jedes Element in einer Hauptgruppe hat die gleiche Anzahl von Valenzelektronen und deshalb ähnliche Bindungsfähigkeiten. Zum Beispiel hat Kohlenstoff vier Valenzelektronen und kann daher vier kovalente Bindungen eingehen.
Es gibt jedoch auch Ausnahmen. Zum Beispiel können die sogenannten Übergangsmetalle unterschiedliche Wertigkeiten aufweisen. Das liegt daran, dass sie nicht nur ihre äußersten Valenzelektronen nutzen können, sondern auch Elektronen aus inneren Schalen. Ein konkretes Beispiel wäre Eisen, das sowohl eine Wertigkeit von 2 als auch von 3 haben kann, was durch seine Elektronenkonfiguration erklärbar ist.
Eine weitere Ausnahme betrifft Edelgase, die normalerweise keine chemischen Bindungen eingehen, weil sie bereits eine stabile Edelgaskonfiguration erreicht haben. Somit haben sie im Normalfall eine Wertigkeit von null.
Schließlich spielt die Elektronegativität eine wichtige Rolle bei der Bestimmung der Wertigkeit. Elemente mit hoher Elektronegativität tendieren dazu, Elektronen anzuziehen und negative Ionen zu bilden. Diese Prozesse können ebenfalls die effektive Wertigkeit in verschiedenen Verbindungen beeinflussen.
Anwendungen in der chemischen Bindung
In der chemischen Bindung spielt die Wertigkeit eine entscheidende Rolle. Sie bestimmt, wie viele Bindungen ein Atom eingehen kann und somit seine Bindungsfähigkeit. Hierbei hängt die Wertigkeit von der Anzahl der Valenzelektronen ab – das sind die Elektronen in der äußersten Schale eines Atoms.
Ein Paradebeispiel für den Einfluss der Wertigkeit ist die kovalente Bindung. Bei dieser Form der Bindung teilen sich zwei Atome ihre Valenzelektronen, um die angestrebte Edelgaskonfiguration zu erreichen. Wasserstoff hat beispielsweise eine Wertigkeit von 1 und bildet daher eine Einzelbindung, während Sauerstoff mit einer Wertigkeit von 2 zwei Bindungen eingeht.
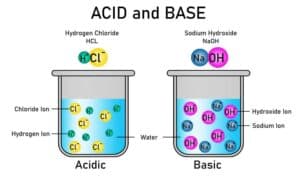
Ebenso gibt es die ionische Bindung, bei der Atome Elektronen vollständig übertragen, um Ionen zu bilden und dadurch eine stabile Konfiguration zu erzielen. Natrium mit einer Wertigkeit von 1 gibt beispielsweise ein Elektron an Chlor (Wertigkeit 1) ab, was zur Bildung von NaCl führt.
Auch in der Molekülbildung spiegelt sich die Relevanz der Wertigkeit wider: Die spezifische Bindigkeitszahl jedes Elements beeinflusst die Struktur und Stabilität des resultierenden Moleküls. In komplexeren Verbindungen oder großen Molekülen wie Proteinen spielt die genaue Bestimmung der Wertigkeiten der beteiligten Elemente eine zentrale Rolle.
Letztlich ist die Wertigkeit auch für die Berechnung der Oxidationszahl relevant, die wiederum die Reaktionsfähigkeit eines Elements beschreibt. Die Kenntnis über Wertigkeiten hilft Chemikern dabei, neue Substanzen gezielt herzustellen und deren Eigenschaften vorherzusagen.
| Element | Symbol | Wertigkeit |
|---|---|---|
| Wasserstoff | H | 1 |
| Sauerstoff | O | 2 |
| Kohlenstoff | C | 4 |
| Eisen | Fe | 2, 3 |
| Natrium | Na | 1 |
| Chlor | Cl | 1, 3, 5, 7 |
Beispiele für Verbindungen und Reaktionen
Ein typisches Beispiel für die Wertigkeit in der Chemie ist die Bildung von Wasser (H2O). Hierbei verbindet sich ein Sauerstoffatom, das eine Wertigkeit von 2 hat, mit zwei Wasserstoffatomen, die jeweils die Wertigkeit 1 aufweisen. Diese Atombindung resultiert aus der Kovalenten Bindung, bei der Elektronen zwischen Atomen geteilt werden, um eine stabile Elektronenkonfiguration zu erreichen.
Ein weiteres bekanntes Beispiel ist Natriumchlorid (NaCl), besser bekannt als Kochsalz. Hierbei reagiert ein Natriumatom (Wertigkeit 1) mit einem Chloratom (ebenfalls Wertigkeit 1) durch die Bildung einer Ionischen Bindung. In diesem Prozess verliert das Natriumatom ein Elektron und wird zu einem positiv geladenen Natriumion (Na+), während das Chloratom ein Elektron aufnimmt und zu einem negativ geladenen Chloridion (Cl–) wird.
Auch die Formation von Methan (CH4) zeigt deutlich die Prinzipien der Bindungsfähigkeit. Kohlenstoff hat vier Valenzelektronen und benötigt vier zusätzliche Elektronen, um die Edelgaskonfiguration zu erreichen. Daher verbindet es sich mit vier Wasserstoffatomen mittels Kovalenter Bindungen.
Solche Beispiele verdeutlichen, wie verschiedene Elemente miteinander interagieren und chemische Verbindungen bilden gemäß ihrer vereinbarte Elektronenkonfiguration. Das Verständnis dieser Prozesse ermöglicht es Wissenschaftlerinnen und Wissenschaftlern, neue Materialien zu entwickeln und chemische Reaktionen gezielt zu steuern.
Bedeutung der Wertigkeit in Molekülstrukturen
In Molekülstrukturen spielt die Wertigkeit eine zentrale Rolle. Sie bestimmt, wie Atome miteinander interagieren und sich zu Stoffen verbinden. Beispielsweise hängt die Anzahl an möglichen Bindungen eines Atoms von seiner Bindungsfähigkeit ab, die wiederum durch die Zahl der Valenzelektronen in der äußeren Schale festgelegt wird.
Das Verständnis der Wertigkeit hilft dabei, die Reaktionsfähigkeit eines Elements zu erklären. So hat ein Kohlenstoffatom mit vier Valenzelektronen die Möglichkeit, vier kovalente Bindungen einzugehen, was ihm erlaubt, vielfältige und komplexe Molekülstrukturen wie Kohlenwasserstoffe zu bilden.
Besondere Bedeutung kommt der Edelgaskonfiguration zu. Atome streben nach einer Elektronenverteilung, die der Edelgase entspricht, da diese besonders stabil ist. Dies treibt sie dazu, entweder Elektronen aufzunehmen oder abzugeben, um ihre äußere Valenzschale zu füllen. Die daraus resultierenden Ionenbindungen und Kovalentbindungen formen schließlich stabile chemische Verbindungen.
Ein weiterer wichtiger Aspekt ist die Elektronegativität, die beeinflusst, wie stark ein Atom Elektronen anzieht. Elemente mit hoher Elektronegativität neigen dazu, Elektronen aufzunehmen, während solche mit niedrigerer Elektronegativität eher Elektronen abgeben. Diese Unterschiede führen zu unterschiedlichen chemischen Verbindungen und letztlich zur Vielfalt der Molekülstrukturen.
Die Wertigkeit erklärt somit nicht nur das Zustandekommen von Bindungen zwischen Atomen, sondern auch deren spezifische geometrische Anordnung innerhalb eines Moleküls. Diese Strukturen bestimmen maßgeblich die physikalischen und chemischen Eigenschaften des Stoffes.
Wertigkeit in der Praxis: Alltag und Industrie
Die Wertigkeit spielt eine zentrale Rolle sowohl im Alltag als auch in der Industrie. Viele alltägliche Produkte wie Kunststoffe, Medikamente und Reinigungsmittel basieren auf chemischen Verbindungen, deren Zusammensetzung durch die Wertigkeit der beteiligten Elemente bestimmt wird.
In industriellen Prozessen ist das Wissen um die Bindungsfähigkeit von Atomen entscheidend für die Entwicklung neuer Materialien und die Optimierung bestehender Produktionen. Zum Beispiel wird bei der Herstellung von Stahl genau darauf geachtet, welche Atome mit welchem Wertigkeit aneinander binden, um das gewünschte Materialverhalten zu erzielen.
Auch in der Pharmazie ist es wichtig, die Bindungsmöglichkeiten von Molekülen zu kennen. Die Wertigkeit beeinflusst die Molekülstruktur, die wiederum maßgeblich für die Wirkung eines Medikaments verantwortlich ist. Hierbei wird oft mit modifizierten Wertigkeiten gearbeitet, um gezielt Eigenschaften wie Lösungsmittelbeständigkeit oder Bioverfügbarkeit zu steuern.
Ein weiteres praktisches Anwendungsgebiet der Wertigkeit befindet sich in der Umwelttechnik. Technologien zur Wasseraufbereitung und Abgasreinigung beruhen darauf, dass bestimmte Chemikalien spezifisch miteinander reagieren. Die Kenntnis der elektronischen Konfigurationen ermöglicht es, effiziente Filtrations- und Reaktionsverfahren zu entwickeln.
Zusammengefasst lässt sich feststellen, dass das Verständnis der Wertigkeit nicht nur theoretische Bedeutung hat, sondern ganz konkrete Auswirkungen auf unser Leben und industrielle Anwendungen besitzt.