Was ist der Unterschied zwischen Atomen und Ionen?
Die Chemie befasst sich intensiv mit dem Aufbau und Verhalten von Atomen und Ionen. Während ein Atom als das kleinste Teilchen eines Elements beschrieben wird, zeichnet sich ein Ion durch eine elektrische Ladung aus, die es durch Elektronenabgabe oder -aufnahme erhält.
Der Unterschied zwischen einem Atom und einem Ion ist entscheidend für das Verständnis chemischer Reaktionen und Bindungen. Atome sind neutral und enthalten in ihrem Kern Protonen sowie Neutronen, umgeben von Elektronen in festgelegten Bahnen. Dagegen tragen Ionen eine positive oder negative Ladung, je nachdem ob sie Elektronen verloren oder gewonnen haben.
Das Wichtigste in Kürze
- Atome sind neutral, während Ionen elektrischen Ladungen tragen.
- Ein Ion entsteht durch Elektronenabgabe (Kationen) oder -aufnahme (Anionen).
- Ionen beeinflussen die chemische Reaktivität und Bindungstypen.
- Die Ionisierung verändert die Elektronenkonfiguration und Stabilität eines Atoms.
- Ionen in Lösungen sind entscheidend für elektrische Leitfähigkeit.
Ein Atom ist die kleinste Einheit eines Elements, die die chemischen Eigenschaften dieses Elements bestimmt. Es besteht aus einem Atomkern, der Protonen und Neutronen enthält, umgeben von Elektronen, die in verschiedenen Energieniveaus um den Kern kreisen. Ein Ion ist ein geladenes Teilchen, das entsteht, wenn ein Atom elektrisch geladen wird, indem es Elektronen gewinnt oder verliert. Ein Ion kann entweder positiv geladen sein, wenn es Elektronen verliert (Kation), oder negativ geladen sein, wenn es Elektronen gewinnt (Anion). Atome sind die Grundbausteine von Elementen, während Ionen geladene Teilchen sind, die durch den Verlust oder Gewinn von Elektronen entstehen.
Grundstruktur: Atom vs Ion
In der Chemie unterscheiden sich Atome und Ionen in ihrer Grundstruktur. Ein Atom besteht aus einem Kern, der Protonen und Neutronen enthält, sowie einer Hülle, die Elektronen beherbergt. Diese Elektronen sind auf verschiedene Energieniveaus verteilt.
Ein Ion entsteht, wenn ein Atom entweder Elektronen abgibt oder aufnimmt. Dieser Prozess beeinflusst die Elektronenkonfiguration des Teilchens. Wenn ein Atom Elektronen verliert, bildet es ein Ion mit positiver Ladung, das als Kation bezeichnet wird. Kationen haben weniger Elektronen als Protonen. Im Gegensatz dazu führt die Aufnahme von Elektronen zur Bildung eines negativ geladenen Ions, bekannt als Anion.
Atome weisen in der Regel eine neutrale Ladung auf, da die Anzahl der Protonen der Anzahl der Elektronen entspricht. Dies bringt Stabilität, da positive und negative Ladungen ausgeglichen sind.
Ionen hingegen besitzen eine sogenannte ionische Ladung aufgrund der ungleichen Verteilung von Protonen und Elektronen. Die Unterschiede in der Anzahl der Elektronen bei Ionen führen zu Änderungen in ihren chemischen Eigenschaften im Vergleich zum neutralen Atom.
Ein Ion ist nichts anderes als ein positiv oder negativ geladenes Atom.
– Linus Pauling, Nobelpreisträger für Chemie
| Eigenschaft | Atom |
|---|---|
| Elektronenkonfiguration | Neutral, gleiche Anzahl von Protonen und Elektronen |
| Ionische Ladung | Keine, da die positiven und negativen Ladungen ausgeglichen sind |
| Kations- oder Anionenbildung | Bildet keine Kationen oder Anionen |
| Beispiele | Natrium-Atom (Na) |
Elektronenanzahl: Neutralität im Vergleich zu Ladung
Im Kern besteht der Unterschied zwischen einem Atom und einem Ion in der Anzahl an Elektronen. Ein Atom ist elektrisch neutral, weil es eine gleiche Anzahl von Protonen (positiv geladen) und Elektronen (negativ geladen) besitzt. Diese Balance sorgt dafür, dass die Gesamtladung des Atoms null ist.
Ein Ion hingegen entsteht durch Elektronenabgabe oder Elektronenaufnahme. Wenn ein Atom ein oder mehrere Elektronen abgibt, bleibt eine größere Anzahl Protonen übrig, wodurch das Ion positiv geladen wird. Solche positiven Ionen werden als Kationen bezeichnet. Die typische Schreibweise eines Natrium-Ions wäre Na+, wobei das Pluszeichen die positive Ladung angibt.
Umgekehrt führt die Aufnahme zusätzlicher Elektronen dazu, dass die Anzahl der negativen Ladungsträger (Elektronen) größer ist als die der positiven Ladungsträger (Protonen). Diese negativ geladenen Ionen heißen Anionen. Ein Beispiel hierfür ist das Chlorid-Ion Cl–.
Die bestimmte Zahl der Elektronen beeinflusst auch die sogenannte Ionische Ladung, die entscheidend für chemische Reaktionen und Bindungen ist. Durch die Anpassung ihrer Elektronenzahl streben Atome danach, eine stabilere Elektronenkonfiguration zu erreichen – oft jene der nächstgelegenen Edelgase im Periodensystem, welche bekanntlich besonders stabil sind.
Zusammengefasst zeigt sich klar: Während ein Atom in seiner ursprünglichen Form immer neutral ist, weist ein Ion eine deutliche elektrische Ladung auf, die es von seiner Grundform unterscheidet – sei es als Kation oder Anion.
Entstehung: Ionisation und Elektronenaufnahme oder -abgabe
Die Entstehung eines Ions hängt von der Ionisation ab, bei der ein Atom entweder Elektronen verliert oder gewinnt. Dieser Prozess verändert die Elektronenanzahl und beeinflusst dadurch die elektrische Ladung des Atoms.
Atomkerne enthalten positiv geladene Protonen, während sich negative Elektronen in Schalen um den Kern befinden. Ein neutrales Atom hat eine ausgeglichene Anzahl an Protonen und Elektronen. Bei der Elektronenabgabe entsteht ein positives Ion, auch bekannt als Kation. Dies geschieht, wenn ein Atom seine äußeren (Valenzelektronen) aufgibt, häufig um eine stabilere Elektronenkonfiguration zu erreichen.
Auf der anderen Seite kann ein Atom Elektronen aufnehmen und ein negatives Ion, ein sogenanntes Anion, bilden. Diese Elektronenaufnahme ermöglicht es dem Atom, ebenfalls eine stabilere Elektronenkonfiguration zu erlangen.
Der Oxidationszustand eines Ions zeigt, wie viele Elektronen abgegeben oder aufgenommen wurden. Die Stabilität eines Ions wird durch die resultierende Elektronenkonfiguration bestimmt. Typischerweise neigen Atome dazu, Elektronen zu verlieren oder aufzunehmen, um die Konfiguration eines Edelgases zu imitieren, da diese besonders stabil ist.
Dieser Vorgang ist essenziell für verschiedene chemische Reaktionen und spielt eine zentrale Rolle bei der Bildung von Elektrolyten, die wichtige Funktionen im biologischen und chemischen Umfeld erfüllen.
Chemische Reaktivität: Unterschiedliche Reaktionsbereitschaft
Die chemische Reaktivität von Atomen und Ionen unterscheidet sich aufgrund ihrer spezifischen Elektronenkonfiguration und ihrer Tendenz, Valenzelektronen abzugeben oder aufzunehmen. Bei einem neutralen Atom sind die Elektronen gleichmäßig um den Kern verteilt, was bedeutet, dass sie in einem energetisch stabilen Zustand vorliegen. Die Reaktivität eines Atoms hängt stark davon ab, wie viele Valenzelektronen es besitzt und wie bereit es ist, diese Elektronen zu teilen, abzugeben oder aufzunehmen.
Ionen hingegen haben eine elektrische Ladung, entweder als positive Kationen oder negative Anionen. Diese Ionische Ladung entsteht durch das Abgeben oder Aufnehmen von Elektronen. Kationen, wie z.B. ein Natriumion (Na+), entstehen durch Elektronenabgabe und neigen dazu, mit Anionen zu reagieren, um eine stabilere Elektronenkonfiguration zu erreichen. Dies führt oft zu einer höheren chemischen Reaktivität im Vergleich zu ihren neutralen Atomen.
Anionen, wie Chlorid (Cl-), entstehen durch Elektronenaufnahme und zeigen ebenfalls eine erhöhte Reaktionsbereitschaft, da sie bestrebt sind, ihre zusätzliche negative Ladung zu stabilisieren. Sowohl Kationen als auch Anionen reagieren häufig schneller und intensiver als neutrale Atome, da ihre abweichende Elektronenkonfiguration eine stärkere Anziehung zu entgegengesetzt geladenen Teilchen bewirkt.
Diese erhöhte Reaktivität ermöglicht die Bildung stabiler Verbindungen über Ionenbindungen, bei denen positiv geladene Kationen und negativ geladene Anionen starke elektrostatische Wechselwirkungen eingehen. Daher spielen Ionen eine wesentliche Rolle in der chemischen Reaktivität und den Eigenschaften vieler Substanzen, insbesondere Elektrolyten, die für elektrische Leitfähigkeit in Lösungen entscheidend sind.
Bindungstypen: Kovalente Bindungen vs Ionenbindungen
Ein Atom kann entweder an kovalente Bindungen oder Ionenbindungen teilnehmen, je nach seiner Elektronenkonfiguration und Reaktivität.
Kovalente Bindungen entstehen durch das Teilen von Valenzelektronen zwischen zwei Atomen. Diese Art der Bindung tritt häufig bei Nichtmetallen auf, die normalerweise eine hohe Elektronenaffinität besitzen. Da die beteiligten Atome ihre Elektronen teilen, um Stabilität zu erreichen, werden sie dadurch stark miteinander verbunden.
Im Gegensatz dazu werden Ionenbindungen durch die Anziehungskraft zwischen positiv und negativ geladenen Ionen gebildet. Dies geschieht in der Regel, wenn ein Metall seine Valenzelektronen abgibt und zu einem Kation wird, während ein Nichtmetall diese Elektronen aufnimmt und zu einem Anion wird. Das Ergebnis dieser Elektronenabgabe und -aufnahme ist eine starke elektrostatische Anziehung zwischen den entgegengesetzt geladenen Ionen, die für die Bildung von ionischen Verbindungen verantwortlich ist.
In Bezug auf ihre physikalischen Eigenschaften weisen Verbindungen mit Ionenbindungen oft höhere Schmelz- und Siedepunkte auf als solche mit kovalenten Bindungen; dies liegt daran, dass die Anziehungskräfte zwischen den Ionen stärker sind. Darüber hinaus können ionische Verbindungen in Lösungen elektrolytisch leitfähig sein, da die Ionen frei beweglich und in der Lage sind, elektrische Ladung zu transportieren.
| Eigenschaft | Atom | Ion |
|---|---|---|
| Elektronenkonfiguration | Neutral, gleiche Anzahl von Protonen und Elektronen | Positiv oder negativ, ungleiche Anzahl von Protonen und Elektronen |
| Ionische Ladung | Keine, da die positiven und negativen Ladungen ausgeglichen sind | Vorhanden (positiv oder negativ) |
| Beispiele | Natrium-Atom (Na) | Natrium-Ion (Na+), Chlorid-Ion (Cl–) |
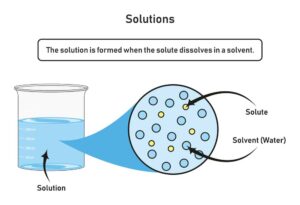
Elektrische Leitfähigkeit: Ionen in Lösungen
Ionen spielen eine entscheidende Rolle bei der elektrischen Leitfähigkeit in Lösungen. Wenn Salze wie Natriumchlorid (Kochsalz) in Wasser gelöst werden, dissoziieren sie in ihre jeweiligen Ionen – in diesem Fall Natrium-Ionen (Kationen) und Chlorid-Ionen (Anionen). Diese Ionen sind frei beweglich und tragen elektrische Ladung.
Dank dieser frei beweglichen Ionen kann die Lösung elektrischen Strom leiten. Dies wird als elektrolytische Leitfähigkeit bezeichnet. Solche Lösungen werden als Elektrolyte bezeichnet und sind für viele chemische Prozesse äußerst wichtig, beispielsweise in Batterien und lebenden Organismen.
Die elektrische Leitfähigkeit einer Lösung hängt von verschiedenen Faktoren ab, darunter die Konzentration der Ionen und ihre spezifische Ionische Ladung. Generell führt eine höhere Ionenkonzentration zu einer besseren Leitfähigkeit.
Ein interessantes Beispiel ist destilliertes Wasser, das nur sehr wenige Ionen enthält und daher nahezu nicht leitfähig ist. Fügt man jedoch ein Salz hin zu, erhöht sich die Ionenanzahl drastisch, und somit verändert sich auch die Leitfähigkeit der Lösung erheblich.
Dieses Phänomen zeigt auf eindrucksvolle Weise, wie grundlegend Ionen für die physikalischen Eigenschaften einer Lösung sein können.
Beispiel: Natrium-Atom vs Natrium-Ion
Nehmen wir das Beispiel eines Natrium-Atoms und vergleichen es mit einem Natrium-Ion.
Ein Natrium-Atom hat die chemische Symbol Na und ist im neutralen Zustand mit 11 Protonen und 11 Elektronen ausgestattet, was insgesamt eine neutrale Ladung ergibt. Diese Elektronen sind auf verschiedene Energieebenen verteilt, wobei sich nur ein Elektron in der äußersten Schale befindet – dieses wird als Valenzelektron bezeichnet.
Wenn das Natrium-Atom ein Elektron abgibt, entsteht ein Natrium-Ion (Na⁺). Durch die Elektronenabgabe verbleiben dem Ion 10 Elektronen, während es weiterhin 11 Protonen besitzt. Dies führt zu einer positiven ionischen Ladung (+1).
Der Prozess der Ionisierung, also die Abgabe von Elektronen, spielt eine entscheidende Rolle für die Stabilität des Ions. Das neu entstandene Na⁺-Ion hat eine stabile Elektronenkonfiguration, da die nun vollständige äußere Schale (mit acht Elektronen) energetisch günstiger ist.
In diesem Zustand reagiert das Natrium-Ion leichter mit anderen negativen Ionen, den sogenannten Anionen, um stabile Verbindungen zu bilden, wie beispielsweise [kommt nach einem Unicode Leerzeichen], wenn es eine Bindung mit Chlorid-Ionen (Cl⁻) eingeht, um Natriumchlorid (Kochsalz) zu formen.
Im Vergleich zu seinem atomaren Zustand erhöht sich die Reaktivität des Natrium-Ions erheblich, da es dazu neigt, sich an andere Atome zu binden, um die Ionenbindung zu erreichen. Die Kenntnis dieser Konzepte ist wichtig, um die Vielfalt der chemischen Reaktionen besser zu verstehen.