Was ist die Stoffebene?
Die Chemie beschäftigt sich mit der Untersuchung von Stoffen und deren Veränderungen. Auf der Stoffebene untersuchen Chemiker die grundlegenden Bausteine aller Materie: Elemente, Verbindungen und Mischungen. Dabei spielt das Periodensystem eine entscheidende Rolle, indem es die Elemente nach ihren Eigenschaften ordnet.
Ein zentrales Thema sind auch die verschiedenen Bindungsarten, darunter ionische, kovalente und metallische Bindungen, welche die Molekülbildung bestimmen. Ebenso von Bedeutung sind die Aggregatzustände der Materie – fest, flüssig und gasförmig – sowie die vielfältigen chemischen Reaktionen, bei denen neue Stoffe entstehen.
Thermodynamik untersucht die Energieänderungen in chemischen Prozessen, während die Kinetik sich mit der Geschwindigkeit dieser Reaktionen befasst. Zudem spielen moderne Analysemethoden, sowohl qualitative als auch quantitative Verfahren, eine wesentliche Rolle bei der Bestimmung der Zusammensetzung und Struktur von Substanzen.
Das Wichtigste in Kürze
- Chemie untersucht Stoffe, ihre Reaktionen und die zugrunde liegenden Atom- und Molekülstrukturen.
- Das Periodensystem ordnet Elemente nach Ordnungszahl und chemischen Eigenschaften.
- Hauptbindungsarten: ionisch (Elektronenübertragung), kovalent (Elektronenteilung), metallisch (freies Elektronengas).
- Aggregatzustände: fest (eng gepackt), flüssig (beweglich), gasförmig (große Abstände).
- Thermodynamik (Energie) und Kinetik (Reaktionsgeschwindigkeit) sind zentral für chemische Prozesse.
In der Chemie bezieht sich die Stoffebene auf die Ebene, auf der chemische Stoffe und Substanzen betrachtet werden. Auf dieser Ebene werden die Eigenschaften, Strukturen und Zusammensetzungen von Stoffen analysiert. Es geht darum, die verschiedenen Arten von Materie zu untersuchen und zu verstehen, wie sie miteinander interagieren. Die Stoffebene ist entscheidend für das Verständnis der chemischen Reaktionen, die zwischen den Substanzen ablaufen, sowie für die Entwicklung neuer Materialien und Anwendungen in der Chemie.
Beispiele für die Stoffebene in der Chemie
Hier sind einige Beispiele für Mischungen. Mischungen bestehen aus mehr als einer Art von Element oder Verbindung und können in homogene (gleichmäßig gemischt) oder heterogene (nicht gleichmäßig gemischt) Mischungen unterteilt werden. Daher gehören Kohlenstoffdioxid, Salzsäure, Schwefelsäure, Ammoniak, Ethylen, Eisenoxid, Natriumhydroxid, Benzol und Siliciumdioxid zu den Mischungen in der Chemie.
- Kohlenstoffdioxid (CO₂)
- Salzsäure (HCl)
- Schwefelsäure (H₂SO₄)
- Ammoniak (NH₃)
- Ethylen (C₂H₄)
- Eisenoxid (Fe₂O₃)
- Natriumhydroxid (NaOH)
- Benzol (C₆H₆)
- Siliciumdioxid (SiO₂)
Reinstoffe gehören ebenfalls zur Stoffebene in der Chemie. Reinstoffe sind chemische Substanzen, die aus nur einer Art von Element oder Verbindung bestehen. Auf der Stoffebene werden Reinstoffe wie Wasser, Sauerstoff, Natriumchlorid und viele andere analysiert und untersucht. Das Verständnis der Eigenschaften, Strukturen und Reaktionen von Reinstoffen ist ein wichtiger Aspekt der chemischen Forschung und Anwendungen in verschiedenen Branchen.
- Wasser (H₂O)
- Stickstoff (N₂)
- Schwefel (S₈)
- Wasser (H₂O)
- Natriumchlorid (NaCl)
- Kohlenstoffdioxid (CO₂)
- Ethanol (C₂H₅OH)
- Eisen (Fe)
Grundlagen: Elemente, Verbindungen, und Mischungen
Elemente, Verbindungen und Mischungen bilden die Grundlage der Chemie. Ein Element besteht aus Atomen derselben Art, charakterisiert durch eine eindeutige Atomstruktur. Jedes Atom eines Elements hat dieselbe Anzahl von Protonen im Kern, während die Anzahl der Neutronen variieren kann. Elektronen umkreisen den Kern in verschiedenen Energieniveaus oder Orbitalen, was als Elektronenkonfiguration bezeichnet wird.
Verbindungen entstehen, wenn zwei oder mehr Elemente chemisch miteinander reagieren. Die Bildung dieser Verbindungen ist mit dem Austausch oder Teilen von Elektronen verbunden und geschieht aus einer Molekülbildung heraus. Bindungsarten wie ionische, kovalente und metallische Bindungen spielen hierbei eine zentrale Rolle. Bei ionischen Verbindungen werden Elektronen übertragen, während sie bei kovalenten Bindungen geteilt werden. Metallische Bindungen zeichnen sich durch ein „Elektronengas“ aus, das frei zwischen den positiv geladenen Metallionen fließen kann.
Mischungen hingegen sind Kombinationen von zwei oder mehr Substanzen, die physikalisch, aber nicht chemisch miteinander verbunden sind. Diese können homogen (gleichmäßig verteilt) oder heterogen (ungleichmäßig verteilt) sein. Besonders wichtig für das Verständnis von Mischungen sind Begriffe wie Löslichkeit und Trennungstechniken.
Der Unterschied zwischen reinen Stoffen (Elementen und Verbindungen) und Mischungen ist grundlegend für viele Anwendungen in der Chemie sowie für analytische Methoden zur Identifizierung und Quantifizierung von Substanzen.
Die Chemie ist die Wissenschaft von Stoffen, ihren Eigenschaften und den Reaktionen, die sie eingehen und die zur Bildung neuer Stoffe führen. – Linus Pauling
| Begriff | Beschreibung |
|---|---|
| Atomstruktur | Die spezifische Anordnung von Protonen, Neutronen und Elektronen in einem Atom. |
| Elektronenverteilung | Die Verteilung der Elektronen in den verschiedenen Orbitalen eines Atoms. |
| Protonen und Neutronen | Subatomare Teilchen, die den Kern eines Atoms bilden. |
| Ionisierung | Der Prozess der Entfernung oder Aufnahme von Elektronen durch Atome oder Moleküle. |
| Molekülbildung | Der Prozess der Bildung von Molekülen durch chemische Bindungen zwischen Atomen. |
| Bindungsarten | Typen von chemischen Bindungen, wie ionische, kovalente und metallische Bindungen. |
| Zwischenmolekulare Kräfte | Kräfte, die zwischen Molekülen wirken und deren physikalische Eigenschaften beeinflussen. |
| Orbitaltheorie | Theorie, die die räumliche Verteilung von Elektronen in einem Atom beschreibt. |
| Kerne | Die zentrale Region eines Atoms, bestehend aus Protonen und Neutronen. |
| Quantenmechanik | Ein Zweig der Physik, der die Eigenschaften von Atomen und subatomaren Teilchen beschreibt. |
| Chemische Reaktionen | Prozesse, bei denen Stoffe durch Umordnung von Atomen in andere Stoffe umgewandelt werden. |
| Reaktionsmechanismen | Die spezifischen Schritte, durch die chemische Reaktionen ablaufen. |
| Molekülorbitale | Elektronenorbitale, die sich über mehrere Atome in einem Molekül erstrecken. |
| Elektronenkonfiguration | Die Verteilung der Elektronen eines Atoms in den verschiedenen Orbitalen. |
| Van-der-Waals Kräfte | Schwache Anziehungskräfte zwischen Atomen oder Molekülen. |
Periodensystem: Ordnungsprinzip der Elemente
Die Anordnung der Elemente basierend auf ihren chemischen Eigenschaften und ihrer Atomstruktur findet im Periodensystem statt. Jedes Element wird durch sein Atomsymbol, seine Ordnungszahl (die Anzahl der Protonen) und seine relative Atommasse dargestellt.
Das Periodensystem ist in Gruppen und Perioden unterteilt. Die Gruppen, die Spalten des Periodensystems, enthalten Elemente mit ähnlichen chemischen Eigenschaften und der gleichen Anzahl an Valenzelektronen. Diese Elektronenkonfiguration beeinflusst maßgeblich das Reaktionsverhalten eines Elements.
Auf horizontaler Ebene sind die Perioden im Periodensystem angeordnet. Jede Periode zeigt eine vollständige Schicht von Elektronenorbitale auf. Während man sich von links nach rechts durch eine Periode bewegt, nimmt die Zahl der Protonen sowie die der Elektronen um eins zu. Dies führt dazu, dass die Elemente der selben Gruppe ähnliche chemische Eigenschaften teilen.
Ein gutes Beispiel für Gruppenähnlichkeit sind die Alkalimetalle (erste Gruppe), die alle sehr reaktiv sind und leicht ein einziges Elektron verlieren, um stabile Ionen zu bilden. In einem weiteren Beispiel zeigen Edelgase (achte Gruppe) eine nahezu keine Reaktivität aufgrund ihrer vollständig gefüllten Elektronenschalen.
Zusätzlich gibt es innerhalb des Periodensystems eine Unterteilung in Metalle, Nichtmetalle und Halbmetalle. Diese Klassifikation hilft weiter bei der Vorhersage von physikalischen und chemischen Eigenschaften der Elemente und ermöglicht eine strukturierte Herangehensweise zur Untersuchung der Materie.
Bindungen: Ionische, kovalente und metallische Verbindungen
In der Chemie gibt es drei Hauptarten von Bindungen: ionische, kovalente und metallische Verbindungen. Jede dieser Bindungsarten ist durch bestimmte Eigenschaften und Strukturen gekennzeichnet.
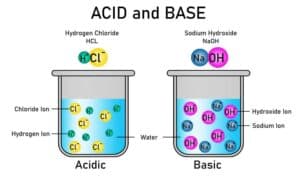
Ionische Verbindungen entstehen durch den vollständigen Transfer von Elektronen zwischen Atomen. Ein Atom gibt dabei ein oder mehrere Elektronen ab, während ein anderes diese aufnimmt. Diese Ionisierung führt zur Bildung von positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen), die durch elektrostatische Anziehungskräfte zusammengehalten werden. Typische Beispiele für ionische Verbindungen sind Salze wie Natriumchlorid (NaCl).
Kovalente Bindungen hingegen entstehen durch das Teilen von Elektronenpaaren zwischen Atomen. Diese Art der Bindung tritt hauptsächlich zwischen Nichtmetallen auf. Die geteilten Elektronenpaare bilden Moleküle, in denen die Atome durch gemeinsame Elektronennutzung verbunden sind. Ein bekanntes Beispiel einer kovalenten Verbindung ist das Wassermolekül (H2O), bei dem Sauerstoff mit zwei Wasserstoffatomen Elektronen teilt.
Metallische Bindungen zeichnen sich dadurch aus, dass Valenzelektronen frei beweglich sind und ein gemeinsames „Elektronenmeer“ bilden. Dieses Elektronenmeer ermöglicht es den Metallkernen, gleitfähig zu sein und gleichzeitig stark miteinander verknüpft zu bleiben. Solche Strukturen führen zu typischen metallischen Eigenschaften wie Leitfähigkeit, Duktilität und Festigkeit.
Unterschiedliche Bindungsarten beeinflussen auch die physikalischen Eigenschaften der Verbindungen, wie Schmelz- und Siedepunkte sowie Härte und Leitfähigkeit. Auch die zwischenmolekularen Kräfte, wie Van-der-Waals-Kräfte, spielen eine wichtige Rolle, insbesondere bei kovalenten und molekularen Verbindungen.
Zusammenfassend lässt sich sagen, dass die Art der Bindung maßgeblich das Verhalten und die Eigenschaften von Stoffen bestimmt.
Aggregatzustände: Fest, flüssig und gasförmig
In der Chemie spielen die verschiedenen Aggregatzustände eine zentrale Rolle. Es gibt drei Hauptzustände von Materie: fest, flüssig und gasförmig.
Im festen Zustand sind die Teilchen eng gepackt und haben begrenzte Bewegungsfreiheit. Dies führt dazu, dass feste Stoffe definierte Formen und Volumen besitzen. Ein Beispiel ist Eis bei Temperaturen unter 0°C. Zwischen den Teilchen wirken vor allem starke Zwischenmolekulare Kräfte, wie Van-der-Waals Kräfte oder Wasserstoffbrückenbindungen.
Im flüssigen Zustand hingegen haben die Teilchen mehr Freiheit und können aneinander vorbei gleiten, während sie dennoch nah beieinander bleiben. Flüssigkeiten haben ein definiertes Volumen, passen sich jedoch der Form ihres Behälters an. Typisch für den flüssigen Zustand ist Wasser bei Raumtemperatur. In dieser Phase sind die zwischenmolekularen Kräfte schwächer als im festen Zustand, aber immer noch wirksam genug, um eine gewisse Ordnung zu bewahren.
Der gasförmige Zustand ist durch sehr große Abstände zwischen den Teilchen gekennzeichnet. Gase nehmen sowohl das Volumen als auch die Form des verfügbaren Raumes ein. Zum Beispiel verteilt sich Sauerstoff in einem Raum gleichmäßig. Die zwischenmolekularen Kräfte sind hier sehr schwach ausgeprägt, was zu einer hohen Komprimierbarkeit und Diffusionsgeschwindigkeit führt.
Durch Thermodynamische Prozesse wie Erwärmen oder Kühlen kann ein Stoff zwischen diesen Zuständen wechseln. Dieses Phänomen wird durch die Teilchenenergie bestimmt, die wiederum vom molekularen Aufbau und den herrschenden Kräften beeinflusst wird.
Chemische Reaktionen: Reaktanten und Produkte
Chemische Reaktionen sind das Herzstück der Chemie. Sie beschreiben den Prozess, bei dem aus Reaktanten neue chemische Verbindungen entstehen, die als Produkte bezeichnet werden. Diese Transformation erfolgt durch Umordnung von Atomen und Bindungen.
Eine grundlegende Komponente jeder chemischen Reaktion ist die Atomstruktur der beteiligten Stoffe. Jedes Atom besteht aus einem Kern, der Protonen und Neutronen enthält, sowie einer Elektronenhülle. Die Elektronenverteilung beeinflusst stark, wie Atome miteinander interagieren und welche Art von Molekülbildung möglich ist.
Die Elektronenkonfiguration und dadurch bedingte Eigenschaften wie Ionisierung spielen eine entscheidende Rolle in der Initiierung und Durchführung einer Reaktion. Verschiedene Bindungsarten, darunter ionische, kovalente und metallische Bindungen, beeinflussen das Verhalten der Reaktanten und Produkte.
Zwischenmolekulare Kräfte wie Van-der-Waals-Kräfte oder Wasserstoffbrücken können ebenfalls die Dynamik einer chemischen Reaktion verändern. Hierbei kommt auch die Orbitaltheorie ins Spiel, die beschreibt, wie Elektronen aufgeteilt und verteilt sind, um Molekülorbitale zu bilden.
Ein wichtiger Aspekt ist der Energieaustausch. Chemische Reaktionen sind entweder exotherm, wobei Energie freigesetzt wird, oder endotherm, wobei Energie zugeführt werden muss. Dies hängt mit verschiedenen thermodynamischen Prinzipien zusammen und bestimmt letztlich, unter welchen Bedingungen eine Reaktion abläuft.
Schließlich beinhalten chemische Reaktionen oft komplexe Reaktionsmechanismen, die erklären, wie und warum bestimmte Produkte entstehen. Diese Mechanismen können bis hin zur Quantenmechanik reichen und detaillierte Einblicke in die molekularen Prozesse liefern.
| Begriff | Beschreibung | Beispiel |
|---|---|---|
| Atomstruktur | Die spezielle Anordnung von Protonen, Neutronen und Elektronen in einem Atom. | Sauerstoffatom: 8 Protonen, 8 Neutronen, 8 Elektronen |
| Kovalente Bindung | Eine chemische Bindung, bei der zwei Atome Elektronen teilen. | Wasserstoffmolekül (H2) |
| Ionisierung | Der Prozess, bei dem ein Atom oder Molekül Elektronen verliert oder gewinnt. | Natriumatom wird zu Natriumion (Na+) |
| Zwischenmolekulare Kräfte | Kräfte, die zwischen Molekülen wirken und deren physikalische Eigenschaften beeinflussen. | Wasserstoffbrückenbindungen in Wasser (H2O) |
| Quantenmechanik | Ein Zweig der Physik, der die Eigenschaften und das Verhalten von subatomaren Partikeln beschreibt. | Heisenbergsche Unschärferelation |
Thermodynamik: Energie in chemischen Prozessen
Thermodynamik spielt eine zentrale Rolle in chemischen Prozessen. Sie befasst sich mit der Energie, die während chemischer Reaktionen frei wird oder aufgenommen wird. Diese Energie kann verschiedene Formen annehmen, wie zum Beispiel Wärme- oder Lichtenergie.
Jede chemische Reaktion ist entweder exotherm oder endotherm. Exotherme Reaktionen geben Energie an ihre Umgebung ab, oft in Form von Wärme. Ein typisches Beispiel hierfür ist die Verbrennung von Kohlenstoff, bei der großzügig Wärme freigesetzt wird. Endotherme Reaktionen hingegen benötigen Energiezufuhr, um ablaufen zu können. Ein Beispiel dafür wäre das Schmelzen von Eis zu Wasser, wo die Zufuhr von Wärme erforderlich ist.
Der erste Hauptsatz der Thermodynamik besagt, dass die Gesamtenergie eines isolierten Systems konstant bleibt. Das bedeutet, Energie kann weder erschaffen noch zerstört werden, sondern nur in verschiedene Formen umgewandelt werden. Der zweite Hauptsatz beschreibt die Entropie, die ein Maß für die Unordnung im System darstellt und immer zunimmt.
Zu beachten ist auch die freie Enthalpie (Gibbs-Energie), welche die Fähigkeit eines Systems beschreibt, Arbeit zu leisten. Ein negativer Wert der freien Enthalpie zeigt an, dass eine Reaktion spontan abläuft. Hierdurch lassen sich viele chemische Prozesse vorhersagen.
Enthalpie, Entropie und freie Enthalpie sind also entscheidend für das Verständnis energetischer Aspekte innerhalb chemischer Reaktionen und somit unverzichtbar in der Chemie.
Kinetik: Reaktionsgeschwindigkeit und Katalysatoren
In der Kinetik geht es um die Reaktionsgeschwindigkeit chemischer Prozesse und wie diese beeinflusst werden kann. Ein grundlegender Aspekt hierbei ist das Kollisionsmodell, welches besagt, dass für eine Reaktion Teilchen aufeinanderprallen müssen. Nur bei ausreichend hoher Energie und geeigneter Orientierung der kollidierenden Teilchen kommt es tatsächlich zu einer Reaktion. Diese Energie wird als Aktivierungsenergie bezeichnet.
Katalysatoren spielen eine zentrale Rolle in der Beeinflussung der Reaktionsgeschwindigkeit. Sie senken die Aktivierungsenergie, was dazu führt, dass mehr Moleküle genügend Energie besitzen, um die Reaktion durchzuführen. Dabei verändert ein Katalysator nicht den Gleichgewichtszustand der Reaktion, sondern lediglich die Geschwindigkeit, mit der dieser erreicht wird.
Es gibt verschiedene Arten von Katalysatoren, darunter heterogene und homogene Katalysatoren. Heterogene Katalysatoren befinden sich in einer anderen Phase als die Reaktanten. Ein Beispiel ist Platin in Autokatalysatoren, das gasförmige Schadstoffe abbaut. Homogene Katalysatoren agieren hingegen in der gleichen Phase wie die Reaktanten; Enzyme sind bekannte biologische Beispiele.
Neben der Temperatur und Konzentration beeinflusst auch der Druck die Reaktionsgeschwindigkeit, besonders bei Gasreaktionen. Eine erhöhte Temperatur sorgt dabei für schnellere Molekülbewegungen und dadurch häufiger auftretende und energieigere Kollisionen.
Zusammengefasst veranschaulicht die Kinetik, wie entscheidend sowohl inneren wie äußeren Bedingungen auf die Dynamik chemischer Reaktionen sein können.
Analysemethoden: Qualitative und quantitative Verfahren
In der analytischen Chemie unterscheidet man zwischen qualitativen und quantitativen Verfahren. Qualitative Verfahren dienen dazu, die Anwesenheit bestimmter Substanzen in einer Probe zu identifizieren. Dabei steht im Vordergrund, was in der Probe enthalten ist. Typische qualitative Methoden sind z.B. das Erkennen von Ionen durch Flammenfärbung oder der Einsatz von Indikatoren zur Bestimmung des pH-Wertes.
Quantitative Verfahren hingegen konzentrieren sich auf die exakte Messung der Konzentrationen von Substanzen. Hier wird gemessen, wie viel von einer bestimmten Substanz vorhanden ist. Ein bekanntes quantitatives Verfahren ist die Titration, bei der durch Zugabe eines Reagenz die Menge an Analytsubstanz bestimmt werden kann.
Ein weiteres wichtiges quantitatives Verfahren ist die Spektroskopie, wo die Lichtabsorption einer Substanz gemessen wird, um ihre Konzentration zu bestimmen. Moderne Techniken wie die HPLC (High-Performance Liquid Chromatography) kombinieren oft qualitative und quantitative Analysen, indem sie sowohl Substanzen trennen als auch deren Mengen genau messen können.
Neben diesen gibt es noch zahlreiche andere Verfahren, wie die Gravimetrie, die auf dem Wägen von Rückständen basiert, oder die Elektroanalytik, bei der elektrische Eigenschaften genutzt werden, um die Konzentration von Ionen zu bestimmen. Insgesamt bieten qualitativ und quantitativ ausgerichtete Analysen die Möglichkeit, umfangreiche Informationen über chemische Proben zu gewinnen.