Was ist der Unterschied zwischen Atome und Moleküle?
Das Verständnis des Unterschieds zwischen Atomen und Molekülen ist grundlegend in der Chemie. Ein Atom ist die kleinste Einheit eines Elements, die alle chemischen Eigenschaften dieses Elements trägt. Moleküle hingegen bestehen aus zwei oder mehr Atomen, die durch chemische Bindungen verbunden sind.
Die Natur dieser Verbindungen bestimmt viele physikalische und chemische Eigenschaften von Substanzen. In der Untersuchung sowohl von Atomen als auch von Molekülen spielen Konzepte wie Elementarteilchen, kovalente Bindung und Elektronenkonfiguration eine zentrale Rolle.
Während einzelne Atome durch ihre spezifischen Elementareigenschaften gekennzeichnet sind, erhalten Moleküle ihre Charakteristika durch die Art und Weise, wie Atome sich zu bestimmten Strukturen verbinden. Diese molekulare Struktur beeinflusst Phänomene wie intermolekulare Wechselwirkungen und damit auch die Reaktivität und Stabilität einer Substanz.
Das Wichtigste in Kürze
- Atome sind die kleinsten Einheiten von Elementen mit spezifischen Protonen, Neutronen und Elektronen.
- Moleküle bestehen aus zwei oder mehr Atomen, die durch chemische Bindungen verbunden sind.
- Kovalente Bindungen entstehen durch das Teilen von Elektronenpaaren zwischen Atomen.
- Die Molekülstruktur beeinflusst die physikalischen Eigenschaften wie Schmelz- und Siedepunkte.
- Einzelne Atome und Moleküle zeigen unterschiedliche Reaktivitäten und Stabilities aufgrund ihrer Elektronenkonfiguration.
Ein Atom ist die kleinste Einheit eines Elements, die die chemischen Eigenschaften dieses Elements bestimmt. Es besteht aus einem Atomkern, der Protonen und Neutronen enthält, umgeben von Elektronen, die in verschiedenen Energieniveaus um den Kern kreisen. Ein Molekül hingegen ist eine Gruppe von zwei oder mehr Atomen, die durch chemische Bindungen miteinander verbunden sind. Diese Atome können entweder desselben Elements (z.B. Sauerstoffmolekül, O₂) oder unterschiedlicher Elemente (z.B. Wasser, H₂O) sein. Moleküle sind die kleinste Einheit einer chemischen Verbindung und können aus Atomen desselben oder unterschiedlichen Elements bestehen. Atome sind die Grundbausteine von Elementen, während Moleküle aus einer Gruppe von Atomen bestehen, die durch chemische Bindungen verbunden sind.
Beispiele für Atome und Moleküle in der Chemie
- Atome:
- Wasserstoffatom (H)
- Sauerstoffatom (O)
- Eisenatom (Fe)
- Kohlenstoffatom (C)
- Moleküle:
- Sauerstoffmolekül (O₂)
- Wasser (H₂O)
- Kohlendioxidmolekül (CO₂)
- Ammoniakmolekül (NH₃)
Struktur von Einzelatomen und Molekülverbänden
Die Struktur von Einzelatomen ist relativ einfach, da sie aus einem winzigen Kern bestehen, der Protonen und Neutronen enthält. Um diesen Kern herum befinden sich die Elektronen in verschiedenen Energieniveaus oder Schalen. Diese Elementarteilchen bestimmen die chemischen Eigenschaften des Atoms.
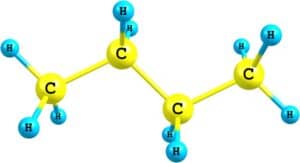
Im Gegensatz dazu sind Moleküle komplexer aufgebaut. Sie entstehen durch die Verbindung von zwei oder mehr Atomen, die durch verschiedene Arten von chemischen Bindungen zusammengehalten werden. Häufig handelt es sich dabei um kovalente Bindungen, bei denen sich Atome Elektronenpaare teilen, um stabile Elektronenkonfigurationen zu erreichen.
Ein einzelnes Atom kann als Grundbaustein betrachtet werden, während ein Molekül die spezifische Anordnung dieser Bausteine innerhalb eines Verbandes darstellt. Moleküle haben daher eine genau definierte Molekülstruktur, welche die räumliche Anordnung der Atome sowie die Längen und Winkel der Bindungen beinhaltet.
Ein Wasserstoffatom beispielsweise besteht nur aus einem einzigen Proton und einem Elektron. Ein Wassermolekül hingegen besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom, die durch kovalente Bindungen zu einer V-Form verknüpft sind. Hierbei spielen Elektronegativität und Molekülorbitale wesentliche Rollen.
Zusammengefasst zeigt diese Gegenüberstellung, dass die Struktur eines Einzelatoms fundamental einfacher ist als die eines Molekülverbandes, was zu ihren unterschiedlichen physikalischen und chemischen Eigenschaften führt.
Chemie ist eine Brücke zwischen Physik und Biologie. Sie baut auf den kleinsten Bausteinen, den Atomen, und zeigt, wie ihre komplexen Verbindungen, die Moleküle, das Leben erschaffen. — Marie Curie
| Eigenschaft | Atom | Molekül |
|---|---|---|
| Größe | Sehr klein | Größer, besteht aus mehreren Atomen |
| Struktur | Einzelne Elementarteilchen | Kombination mehrerer Atome |
| Stabilität | Abhängig von Atomart | Kann stabiler oder reaktiver als Einzelatome sein |
| Bindung | Keine oder ionische Bindung | Kovalente oder andere chemische Bindungen |
| Reaktivität | Varies depending on the element | Depend on molecular structure and composition |
| Beispiel | Wasserstoffatom (H) | Wassermolekül (H2O) |
Chemische Bindungen in Molekülen
In Molekülen sind Atome durch verschiedene chemische Bindungen miteinander verknüpft, wobei kovalente Bindungen eine zentrale Rolle spielen. Bei kovalenten Bindungen teilen sich die beteiligten Atome Elektronenpaare, um stabile Elektronenkonfigurationen zu erreichen. Diese Bindungen entstehen meist zwischen Atomen mit ähnlicher Elektronegativität.
Die starke Wechselwirkung in kovalent gebundenen Molekülen führt zur Stabilität und Beständigkeit ihrer Struktur. Zum Beispiel besteht ein Wassermolekül (H2O) aus zwei Wasserstoffatomen und einem Sauerstoffatom, welche durch geteilte Elektronenpaare verbunden sind.
Darüber hinaus gibt es auch andere Typen von Bindungen in Molekülen wie ionische und metallische Bindungen. In ionischen Verbindungen tauschen Atome Elektronen aus und bilden Ionen, die sich aufgrund elektrostatischer Anziehungskräfte zusammenhalten. Die Art der chemischen Bindung hat einen wesentlichen Einfluss auf die physikalischen Eigenschaften des Moleküls, wie Schmelz- und Siedepunkte sowie Löslichkeit.
Molekülorbitale spielen ebenso eine wichtige Rolle, indem sie die Verteilung und das Verhalten der bindenden Elektronen im Molekül beschreiben. Durch die Überlappung von Atomorbitalen entstehen neue Energiezustände, wodurch sich die Elektronen über mehrere Atome verteilen können.
Chemische Bindungen tragen maßgeblich zur Bildung der Molekülstruktur bei, was wiederum die Reaktivität und Funktion der Moleküle beeinflusst. Intermolekulare Wechselwirkungen wie Van-der-Waals-Kräfte und Wasserstoffbrücken können zusätzlich das Verhalten eines Moleküls bestimmen. Diese komplexen Wechselwirkungen verdeutlichen die Wichtigkeit einer detaillierten Untersuchung chemischer Bindungen.
Physikalische Eigenschaften von Atomen und Molekülen
Atome und Moleküle unterscheiden sich wesentlich in ihren physikalischen Eigenschaften. Atome sind die Grundbausteine der Materie und bestehen aus Protonen, Neutronen und Elektronen. Sie haben eine definierte Größe und Masse, die von der Anzahl ihrer Protonen und Neutronen abhängt. Elementarteilchen wie Protonen und Elektronen bestimmen viele dieser physikalischen Eigenschaften.
Im Gegensatz dazu setzen sich Moleküle aus zwei oder mehr Atomen zusammen, die durch verschiedene chemische Bindungen wie kovalente oder ionische Bindungen verbunden sind. Dadurch besitzen Moleküle spezifische Strukturen und geometrische Anordnungen. Diese Struktur beeinflusst maßgeblich die physikalischen Eigenschaften eines Moleküls, wie Schmelz- und Siedepunkte, sowie seine Löslichkeit in verschiedenen Lösungsmitteln.
Ein weiterer Unterschied betrifft die intermolekularen Wechselwirkungen. Zwischen den Molekülen wirken Kräfte wie van der Waals-Kräfte, Wasserstoffbrückenbindungen oder Dipol-Dipol-Wechselwirkungen. Diese Wechselwirkungen spielen keine Rolle auf der Ebene einzelner Atome, da diese nur intramolekulare Bindungen erkennen.
Die molekulare Masse ist ein weiteres Unterscheidungsmerkmal: Während Atome ihre Masse direkt aus der Summe der Protonen und Neutronen erhalten, ergibt sich die Molekülmasse aus der Summe der Massen aller einzelnen Atome, aus denen das Molekül besteht.
Zusammengefasst zeigen sich Unterschiede in:
- Größe und Masse
- Intermolekularen Wechselwirkungen
- Konstruktionen und Strukturen
Diese Unterschiede bedingen auch unterschiedliche physikalische Verhaltensweisen in chemischen Reaktionen und unter verschiedenen Umgebungsbedingungen.
Reaktivität und Stabilität
In der Chemie haben Atome und Moleküle unterschiedliche Grade an Reaktivität und Stabilität. Einzelne Atome, insbesondere die von Metallen oder Nichtmetallen in ihrer elementaren Form, können oft sehr reaktionsfreudig sein. Dies liegt daran, dass sie selten eine stabile Elektronenkonfiguration erreichen.
Auf der anderen Seite neigen Moleküle dazu, stabiler zu sein als einzelne Atome. Das kommt daher, dass sie bereits durch kovalente Bindungen Elektronenpaare teilen und somit meist eine vollständige Außenschale erreichen, was ihre Stabilität erhöht. Zum Beispiel ist ein Wassermolekül (H2O) durch kovalente Bindungen zwischen den Sauerstoff- und Wasserstoffatomen charakterisiert und besitzt dadurch eine geringere Tendenz, mit anderen Stoffen zu reagieren, im Vergleich zum freien Wasserstoffatom (H).
Die Elektronegativität der beteiligten Atome spielt ebenfalls eine maßgebliche Rolle für die Stabilität eines Moleküls. Atome mit hoher Elektronegativität tendieren dazu, stärker bindende Elektronen anzuziehen, was die Gesamtstabilität des Moleküls erhöht.
Zusätzlich sind intermolekulare Wechselwirkungen wie Van-der-Waals-Kräfte oder Wasserstoffbrückenbindungen entscheidende Faktoren für die Stabilität größerer Moleküle. Je stärker diese Wechselwirkungen, desto schwieriger ist es, das Molekül chemisch zu verändern, was wiederum seine Stabilität erhöht und seine Reaktivität verringert.
Größenskala: atomare vs molekulare Ebene
Die Größenverhältnisse zwischen Atomen und Molekülen sind ein wichtiger Aspekt der Chemie. Ein Atom ist die kleinste Einheit eines chemischen Elements, bestehend aus einem Kern von Protonen und Neutronen sowie einer Hülle von Elektronen. Die atomare Größe wird durch den Atomradius definiert, der im Bereich von 30 bis 300 Pikometern liegt.
Moleküle hingegen bestehen aus zwei oder mehr Atomen, die durch chemische Bindungen wie kovalente Bindungen zusammengehalten werden. Diese Verbindungen führen zu komplexeren Strukturen mit größeren Abmessungen als die Einzelatome. Moleküle können sehr unterschiedlich groß sein, je nach Anzahl und Art der beteiligten Atome sowie der Art der Bindungen zwischen ihnen.
Ein einfaches Molekül wie Wasser (H₂O) hat einen Durchmesser von etwa 0,275 Nanometern, während größere organische Moleküle, etwa Proteine, mehrere Nanometer oder sogar Mikrometer messen können. Die Molekülstruktur sowie die Geometrie spielen hierbei eine entscheidende Rolle und bestimmen die physikalischen und chemischen Eigenschaften des Moleküls.
Während auf atomarer Ebene die Elementarteilchen wie Protonen, Neutronen und Elektronen dominieren, erfordern molekulare Systeme oft die Betrachtung von Molekülorbitalen und intermolekularen Wechselwirkungen. Diese strukturellen Unterschiede haben erhebliche Auswirkungen auf die Reaktivität und Stabilität der Substanzen, was sie zu einem zentralen Thema in vielen Bereichen der Chemie macht.
| Kriterium | Eigenschaften von Atomen | Eigenschaften von Molekülen |
|---|---|---|
| Grundaufbau | Protonen, Neutronen, Elektronen | Verbund mehrere Atome |
| Interaktive Kräfte | Elektrische Ladungen | Intermolekulare Wechselwirkungen |
| Energiezustände | Diskrete Atomorbitale | Komplexe Molekülorbitale |
Funktion in chemischen Reaktionen
In chemischen Reaktionen spielen sowohl Atome als auch Moleküle eine zentrale Rolle. Zunächst sind Atome die grundlegenden Bausteine der Materie, aus denen durch chemische Bindungen größere Strukturen wie Moleküle entstehen. Eine chemische Reaktion kann als Prozess definiert werden, bei dem Atome und Moleküle ihre Struktur verändern oder neue Verbindungen bilden.
Atome reagieren miteinander, um stabilere Zustände zu erreichen, was oft durch die Bildung von Molekülen geschieht. Diese Prozesse beinhalten oft den Austausch oder das Teilen von Elektronen. Die Besonderheit bei Molekülen ist, dass sie aus zwei oder mehr Atomen bestehen, die in einer bestimmten Weise miteinander verbunden sind. In vielen Fällen teilen sich diese Atome Elektronenpaare, um eine kovalente Bindung zu bilden, was ihnen zusätzliche Stabilität verleiht.
Ein Beispiel für eine chemische Reaktion auf molekularer Ebene könnte die Bildung eines Wassermoleküls sein. Hierbei verbinden sich zwei Wasserstoffatome mit einem Sauerstoffatom durch kovalente Bindungen. Innerhalb dieser Molekülstruktur wird die Elektronenkonfiguration neu arrangiert, um energetisch günstigere Zustände zu erreichen.
Die Rolle der Elektronegativität ist ebenfalls entscheidend, wenn es um die Reaktivität von Molekülen geht. Sie bestimmt, wie stark ein Atom Elektronen anzieht und beeinflusst so die Art der Bindung, die entsteht. Zudem gibt es noch intermolekulare Wechselwirkungen, wie Wasserstoffbrückenbindungen, die bei komplexeren Reaktionen eine wichtige Rolle spielen können.
Zusammengefasst ermöglichen die verschiedenen Eigenschaften von Atomen und Molekülen eine Vielzahl chemischer Reaktionen und tragen zur Diversität der beobachtbaren Materiezustände bei.
Beispiele: Wasserstoffatom vs Wassermolekül
Wasserstoffatom und Wassermolekül unterscheiden sich grundlegend in ihrer Struktur und ihren Eigenschaften. Ein Wasserstoffatom besteht aus einem einzelnen Proton als Kern und einem Elektron, das diesen Kern umkreist. Diese einfache Struktur macht das Wasserstoffatom zu dem kleinsten und leichtesten Atom im Periodensystem.
Im Gegensatz dazu ist ein Wassermolekül komplexer aufgebaut. Es besteht aus zwei Wasserstoffatomen, die jeweils über kovalente Bindungen mit einem Sauerstoffatom verbunden sind. Dies führt zur Summenformel H2O. Der Winkel zwischen den beiden H-Atomen beträgt etwa 104,5°, was auf die Elekronenpaar-Abstoßung zurückzuführen ist.
Die Molekülstruktur von Wasser sorgt für eine ungleiche Verteilung der Elektronen. Der Sauerstoff ist elektronegativer als Wasserstoff und zieht die Bindungselektronen stärker an. Dadurch entsteht ein Dipolmoment, wodurch das Wassermolekül polare Eigenschaften erhält.
Ein weiteres Unterscheidungsmerkmal ist ihre Masse: Ein einzelnes Wasserstoffatom hat eine sehr geringe Masse, während die Molekülmasse des Wassermoleküls höher ist. Die intermolekularen Wechselwirkungen im Wasser führen zudem zu speziellen physikalischen Eigenschaften, wie die hohe Siedetemperatur und die Fähigkeit, als Lösungsmittel für viele Substanzen zu dienen.
In chemischen Reaktionen spielen sowohl freie Atome als auch Moleküle eine entscheidende Rolle. Während das einzelne Wasserstoffatom häufig bei Redoxreaktionen beteiligt ist, ist das Wassermolekül oft bei Hydrolysen oder Kondensationsreaktionen aktiv.
Diese Unterschiede verdeutlichen die unterschiedliche Funktion und Bedeutung von Atomen und Molekülen in der Chemie.
Energiezustände verschiedener Teilchen
Energiezustände von Atomen und Molekülen sind entscheidende Parameter, die ihre chemischen und physikalischen Eigenschaften bestimmen. Einzelne Atome befinden sich in spezifischen Energiezuständen, die durch die Elektronenkonfiguration definiert werden. Diese Konfiguration beschreibt, wie Elektronen innerhalb der Atomhülle angeordnet sind.
Im Gegensatz dazu bestehen Moleküle aus mehreren Atomen, die durch kovalente Bindungen zusammengehalten werden. Die Elektronenpaare, welche diese Bindungen bilden, führen zu einer komplexeren Verteilung von Energiezuständen, die als Molekülorbitale bekannt sind. Diese Orbitale zeigen, wie Elektronen in einem Molekül verteilt sind und beeinflussen die gesamte Molekülstruktur.
Durch die Interaktion dieser Molekülorbitale können Moleküle verschiedene energetische Niveaus einnehmen, die nicht nur für chemische Reaktionen, sondern auch für physikalische Phänomene wie Spektroskopie relevant sind. Spektrumlinien entstehen beispielsweise dann, wenn Elektronen zwischen verschiedenen orbitalen Energielevels springen.
Zusätzlich spielen intermolekulare Wechselwirkungen eine Rolle bei der Bestimmung der Energiezustände von Molekülen. Solche Wechselwirkungen, einschließlich Wasserstoffbrückenbindungen und Van-der-Waals-Kräften, tragen erheblich zur Stabilität eines Moleküls bei und beeinflussen dessen physikalische Eigenschaften wie Aggregatzustand und Lösungseigenschaften.
Die Energiedifferenzen zwischen diesen Zuständen erklären unter anderem, warum manche Substanzen bei bestimmten Temperaturen fest, flüssig oder gasförmig sind und warum bestimmte chemische Reaktionen nur unter speziellen Bedingungen stattfinden.